Hepimiz bir yumurta ve sperm hücresinin döllenmesiyle oluşan tek bir hücrenin çoğalmasının eseriyiz ve her hücremiz aynı DNA dizisini barındırır. Ancak karaciğer hücrelerimizden sinir hücrelerimize vücudumuzda yer alan 250 farklı hücre tipi birbirinden oldukça farklıdır ve kendilerine has işlevleri bulunur. Bu farklılaşmalar her hücre tipi için farklı DNA bölgelerinin “açık” ya da “kapalı” olmasıyla sağlanır. Dahası epigenetik olarak adlandırılan bu süreç yalnızca hücre farklılaşması sırasında gerçekleşmez, yaşam biçimimizin ve çevrenin etkisiyle ömrümüz boyunca hangi genlerimizin etkin olacağı değişmeye devam eder. Örneğin sigara kullanımı akciğer hücrelerindeki epigenetik yapıyı değiştirir ve nihayetinde kansere öncülük edebilir. Bilim insanları stres, hastalık ve beslenme düzeni gibi diğer dışsal uyaranların etkilerinin de benzer şekilde hücrelerin epigenetik hafızasında saklandığı tahmin ediyorlar.
Her ne kadar canlıların yaşamları boyunca biriktirdikleri epigenetik değişimler güçlü bir biçimde ortaya konulmuş olsa da bunların yavrulara aktarılıp aktarılamayacağı uzun süredir bilimsel camialarda tartışılmaya devam ediyor. Çoğu bilim insanı yakın zamana kadar epigenetik hafızanın sperm ve yumurta oluşumu sırasında tamamen sıfırlandığını varsayıyorlardı, güncel çalışmalar bu fikri alt üst etmekle birlikte bu aktarımın nasıl gerçekleştiği ve bu genetik modifikasyonların yavrularda nasıl etkileri olduğu henüz tam olarak anlaşılabilmiş değil.
Sıklıkla örnek verilen büyükbabanın beslenme biçimiyle torunların şeker hastalığı ve kardiyovasküler hastalıklara sahip olma riskindeki artış arasındaki bağlantı da dâhil olmak üzere 90’ların başından bu yana pek çok farklı canlıda epigenetik kalıtıma dair bulgular ortaya konulmuştu. Yine de moleküler düzeydeki bulgu ve açıklamalar hala yetersiz.
Max Planck Enstitüsü’nden araştırmacılar 14 Temmuz’da Science’da yayınladıkları çalışmayla hem moleküler düzeyde epigenetik kalıtıma dair bir örnek hem de bunun yavrunun gelişimindeki etkisini gösterdiler. Araştırma annenin epigenetik hafızasının yavruların gelişiminde ve hayatta kalabilmesinde olduğuna dair kanıt sunuyor.
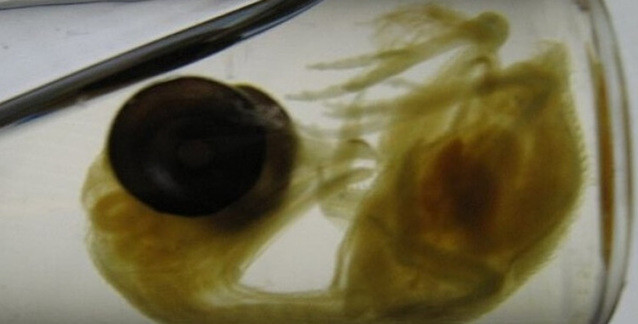
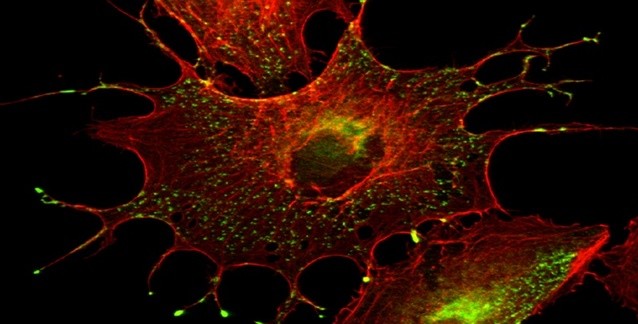
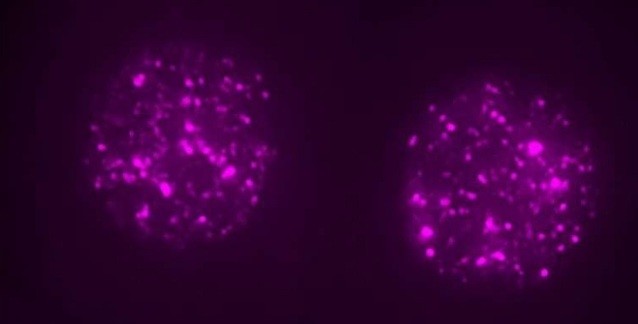
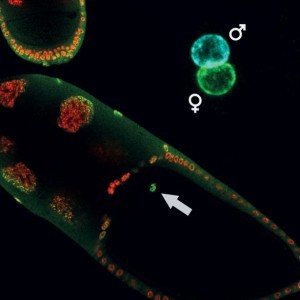 Dişi meyve sineğinin yumurtası ve içindeki görüntülenmek üzere yeşile boyanmış H3K27me3. Bu hücre spermle birlikte sineğin yeni yavrusunu oluşturacak. Sağ üst köşede anneden ve babadan gelen hücre çekirdeklerinin döllenme sırasında birleşmesi gözüküyor. Yeşil renklendirme H3K27me3'ün yalnızca anneden kalıtıldığını ve epigenetik talimatları yavruya aktarabildiğini gösteriyor. Görsel telif: MPI of Immunobiology a. Epigenetics/ F. Zenk
Dişi meyve sineğinin yumurtası ve içindeki görüntülenmek üzere yeşile boyanmış H3K27me3. Bu hücre spermle birlikte sineğin yeni yavrusunu oluşturacak. Sağ üst köşede anneden ve babadan gelen hücre çekirdeklerinin döllenme sırasında birleşmesi gözüküyor. Yeşil renklendirme H3K27me3'ün yalnızca anneden kalıtıldığını ve epigenetik talimatları yavruya aktarabildiğini gösteriyor. Görsel telif: MPI of Immunobiology a. Epigenetics/ F. Zenk
Ekip epigenetik değişimlerin (modifikasyonların) anneden embriyoya nasıl aktarıldığını araştırmak için meyve sineğini (Drosophila) kullandı ve insanda da bulunan H3K27me3 olarak isimlendirilen belirli bir modifikasyona odaklandı. H3K27me3 kromatin olarak isimlendirilen hücre çekirdeğindeki DNA paketlenmesini değiştiriyor ve esas olarak gen ifadesini (RNA üretimini) baskılamakla ilişkili bir modifikasyon.
Araştırmacılar annenin yumurta hücresindeki başka epigenetik işaretler silinirken kromatin DNA’sını etiketleyen H3K27me3 modifikasyonunun döllenmeden sonra da varlığını koruduğunu keşfettiler. Ancak araştırmacılar yalnızca bu modifikasyonun aktarılmasıyla değil, bunun embriyo üzerinde önemli bir etkisinin olup olmadığını da merak ediyorlardı.
Bu nedenle araştırmacılar meyve sineğinde H3K27me3 işaretini oluşturan enzimleri kaldırmak için çeşitli genetik araçlar kullandılar ve gelişimin erken aşamasında H3K27me3 bulunmayan embriyonun son aşamaya kadar gelişemediğini keşfettiler. Araştırmacılara göre bu epigenetik bilginin yalnızca bir nesilden diğerine aktarılmakla kalmadığını aynı zamanda embriyonun gelişimi için vazgeçilmez olduğunu ortaya koyuyor.
Embriyoları yakından incelediğinde ekip normalde kapalı olan bir takım gelişimsel genin H3K27me3 yokluğunda açıldığını tespit ettiler. Ekip bu genlerin gelişim sırasında çok erken aktif hale gelmesinin embriyo gelişimini engellediğini ve sonucunda embriyonun ölümüyle sonuçlandığını varsaydıklarını aktarıyor. Kalıtılan epigenetik bilginin genetik kodun doğru biçimde ifade edilebilmesi için gerekli olduğu sonucuna varıyorlar.
Max Planck araştırmacılarının ulaştığı sonuçlar yalnızca nesiller boyunca aktarılmakla kalmayıp dahası erken embiyo gelişimindeki karmaşık gen aktivasyon süreçlerini kontrol eden bir öneme sahip olduğunu göstermesi, kalıtımın tam olarak anlaşılması için önemli bir adım. Ekibe göre bu en azından bazı vakalarda çevresel adaptasyonların aktarılmasının incelenmesi için yeni bir zemin sunuyor. Bunun ötesinde çevremiz ve yaşam biçimimiz epigenetik mekanizmaların engellenmesi kanser, şeker ve otoimmün gibi hastalıklarla ilişkili olabilir ve bu yeni bulguların insan sağlığı açısından uygulamaları olabilir.
Sitemizde yer alan başka örneklere göz atabilirsiniz: “Romantik Aşk” Efsanesi Sağlığınızı Bozabilir, A ve C Vitaminleri, Hücre Hafızasının Silinmesine Yardımcı Oluyor, Kalp Krizi Anısı Genlerimize Kaydediliyor, Çay Tüketimi Kadınlarda Epigenetik Değişikliklere Neden Oluyor
Epigenetik kalıtımla ilgili önceki haberlerimizi okuyabilirsiniz: Kötü Yaşam Tercihlerimiz DNA Aracılığıyla Gelecek Nesillere Aktarılabiliyor, Çevresel Hafızalar Dededen Toruna Aktarıldı, Ebeveynlerin Yaşadığı Çevrenin Çocuğun DNA’sını Nasıl Etkilediğine İlk Delil, Yaşam Tarzınız Doğacak Çocuğunuzu Etkileyebilir
Bu haber Max Planck Enstitüsü’nün haberi ve ilgili makale Germ line–inherited H3K27me3 restricts enhancer function during maternal-to-zygotic transition (DOI: 10.1126/science.aam5339) esas alınarak ve kısmen çevrilerek hazırlanmıştır.
Her ne kadar canlıların yaşamları boyunca biriktirdikleri epigenetik değişimler güçlü bir biçimde ortaya konulmuş olsa da bunların yavrulara aktarılıp aktarılamayacağı uzun süredir bilimsel camialarda tartışılmaya devam ediyor. Çoğu bilim insanı yakın zamana kadar epigenetik hafızanın sperm ve yumurta oluşumu sırasında tamamen sıfırlandığını varsayıyorlardı, güncel çalışmalar bu fikri alt üst etmekle birlikte bu aktarımın nasıl gerçekleştiği ve bu genetik modifikasyonların yavrularda nasıl etkileri olduğu henüz tam olarak anlaşılabilmiş değil.
Biyolojik Kalıtımın Genlerden İbaret Olmadığına Dair Yeni Bir Kanıt
Sıklıkla örnek verilen büyükbabanın beslenme biçimiyle torunların şeker hastalığı ve kardiyovasküler hastalıklara sahip olma riskindeki artış arasındaki bağlantı da dâhil olmak üzere 90’ların başından bu yana pek çok farklı canlıda epigenetik kalıtıma dair bulgular ortaya konulmuştu. Yine de moleküler düzeydeki bulgu ve açıklamalar hala yetersiz.
Max Planck Enstitüsü’nden araştırmacılar 14 Temmuz’da Science’da yayınladıkları çalışmayla hem moleküler düzeyde epigenetik kalıtıma dair bir örnek hem de bunun yavrunun gelişimindeki etkisini gösterdiler. Araştırma annenin epigenetik hafızasının yavruların gelişiminde ve hayatta kalabilmesinde olduğuna dair kanıt sunuyor.
 Dişi meyve sineğinin yumurtası ve içindeki görüntülenmek üzere yeşile boyanmış H3K27me3. Bu hücre spermle birlikte sineğin yeni yavrusunu oluşturacak. Sağ üst köşede anneden ve babadan gelen hücre çekirdeklerinin döllenme sırasında birleşmesi gözüküyor. Yeşil renklendirme H3K27me3'ün yalnızca anneden kalıtıldığını ve epigenetik talimatları yavruya aktarabildiğini gösteriyor. Görsel telif: MPI of Immunobiology a. Epigenetics/ F. Zenk
Dişi meyve sineğinin yumurtası ve içindeki görüntülenmek üzere yeşile boyanmış H3K27me3. Bu hücre spermle birlikte sineğin yeni yavrusunu oluşturacak. Sağ üst köşede anneden ve babadan gelen hücre çekirdeklerinin döllenme sırasında birleşmesi gözüküyor. Yeşil renklendirme H3K27me3'ün yalnızca anneden kalıtıldığını ve epigenetik talimatları yavruya aktarabildiğini gösteriyor. Görsel telif: MPI of Immunobiology a. Epigenetics/ F. ZenkEkip epigenetik değişimlerin (modifikasyonların) anneden embriyoya nasıl aktarıldığını araştırmak için meyve sineğini (Drosophila) kullandı ve insanda da bulunan H3K27me3 olarak isimlendirilen belirli bir modifikasyona odaklandı. H3K27me3 kromatin olarak isimlendirilen hücre çekirdeğindeki DNA paketlenmesini değiştiriyor ve esas olarak gen ifadesini (RNA üretimini) baskılamakla ilişkili bir modifikasyon.
Araştırmacılar annenin yumurta hücresindeki başka epigenetik işaretler silinirken kromatin DNA’sını etiketleyen H3K27me3 modifikasyonunun döllenmeden sonra da varlığını koruduğunu keşfettiler. Ancak araştırmacılar yalnızca bu modifikasyonun aktarılmasıyla değil, bunun embriyo üzerinde önemli bir etkisinin olup olmadığını da merak ediyorlardı.
Kalıtılan Epigenetik İşaretler Embriyo Oluşumu İçin Önemli
Bu nedenle araştırmacılar meyve sineğinde H3K27me3 işaretini oluşturan enzimleri kaldırmak için çeşitli genetik araçlar kullandılar ve gelişimin erken aşamasında H3K27me3 bulunmayan embriyonun son aşamaya kadar gelişemediğini keşfettiler. Araştırmacılara göre bu epigenetik bilginin yalnızca bir nesilden diğerine aktarılmakla kalmadığını aynı zamanda embriyonun gelişimi için vazgeçilmez olduğunu ortaya koyuyor.
Embriyoları yakından incelediğinde ekip normalde kapalı olan bir takım gelişimsel genin H3K27me3 yokluğunda açıldığını tespit ettiler. Ekip bu genlerin gelişim sırasında çok erken aktif hale gelmesinin embriyo gelişimini engellediğini ve sonucunda embriyonun ölümüyle sonuçlandığını varsaydıklarını aktarıyor. Kalıtılan epigenetik bilginin genetik kodun doğru biçimde ifade edilebilmesi için gerekli olduğu sonucuna varıyorlar.
Max Planck araştırmacılarının ulaştığı sonuçlar yalnızca nesiller boyunca aktarılmakla kalmayıp dahası erken embiyo gelişimindeki karmaşık gen aktivasyon süreçlerini kontrol eden bir öneme sahip olduğunu göstermesi, kalıtımın tam olarak anlaşılması için önemli bir adım. Ekibe göre bu en azından bazı vakalarda çevresel adaptasyonların aktarılmasının incelenmesi için yeni bir zemin sunuyor. Bunun ötesinde çevremiz ve yaşam biçimimiz epigenetik mekanizmaların engellenmesi kanser, şeker ve otoimmün gibi hastalıklarla ilişkili olabilir ve bu yeni bulguların insan sağlığı açısından uygulamaları olabilir.
Sitemizde yer alan başka örneklere göz atabilirsiniz: “Romantik Aşk” Efsanesi Sağlığınızı Bozabilir, A ve C Vitaminleri, Hücre Hafızasının Silinmesine Yardımcı Oluyor, Kalp Krizi Anısı Genlerimize Kaydediliyor, Çay Tüketimi Kadınlarda Epigenetik Değişikliklere Neden Oluyor
Epigenetik kalıtımla ilgili önceki haberlerimizi okuyabilirsiniz: Kötü Yaşam Tercihlerimiz DNA Aracılığıyla Gelecek Nesillere Aktarılabiliyor, Çevresel Hafızalar Dededen Toruna Aktarıldı, Ebeveynlerin Yaşadığı Çevrenin Çocuğun DNA’sını Nasıl Etkilediğine İlk Delil, Yaşam Tarzınız Doğacak Çocuğunuzu Etkileyebilir
Bu haber Max Planck Enstitüsü’nün haberi ve ilgili makale Germ line–inherited H3K27me3 restricts enhancer function during maternal-to-zygotic transition (DOI: 10.1126/science.aam5339) esas alınarak ve kısmen çevrilerek hazırlanmıştır.
Bu içerik BilimFili.com yazarı tarafından oluşturulmuştur. BilimFili.com`un belirtmiş olduğu “Kullanım İzinleri”ne bağlı kalmak kaydıyla kullanabilirsiniz.
Kaynak ve İleri Okuma
Etiket
Projelerimizde bize destek olmak ister misiniz?
Dilediğiniz miktarda aylık veya tek seferlik bağış yapabilirsiniz.
Destek Ol
Yorum Yap (0)
Bunlar da İlginizi Çekebilir
08 Mart 2015
Fetüs Genetiği, Annede Kanser Teşhisi Sağlıyor
27 Nisan 2016
Yüzümüzdeki Kök Hücreler, Yüzümüzü Nasıl Oluşturuyor?
25 Ocak 2017
Kök Hücrelerden İnsan Dünyaya Getirmek