Organ nakli bekleyen hastaların sayısı her geçen gün artıyor. Bu süreç, hem hastalar hem de hasta yakınları için oldukça zor bir süreç ve maalesef bu süreçte birçok hasta hayatını kaybediyor. Dünyada organ bağışı yapan kişilerin sayısı her geçen gün artsa da ne yazık ki hala yeterli sayıya ulaşmış değil. Bu nedenle bilim insanları alternatif çözümler üretmeye çalışıyorlar.
Şu anda 3D yazıcılar bu açıdan hayli önem kazanan bir konumda. Bu yazıcılar ilk çıktığında, akla gelen ilk şeylerden biri yapay organların bu yazıcılarla üretilme fikriydi. Gerek bilim insanları gerekse organ bekleyen milyonlarca hasta için bu fikir oldukça heyecan vericiydi. Ancak tam olarak işlevsel bir organın üretimi oldukça zor ve karmaşık bir süreçtir. Bu konuda ilerleme kaydedilse de, henüz aşılması gereken çok sayıda engel var.
Diğer alternatiflerden birisi de diğer hayvanlardan insana organ naklinin yapılabilmesi fikri. Bu fikir ilk başta pek mümkün görünmüyordu çünkü günümüzde insandan insana yapılan nakillerde bile organın, alıcının immün sistemi tarafından reddedilmesi başta olmak üzere; birçok sıkıntıyla karşılaşılırken, türler arası nakil nasıl gerçekleşebilirdi ki? Bir türün dokusunun farklı bir türe nakledildiği ksenontransplantasyon isimli süreç, organ yetmezliği olan hastaların, dokularının ve organlarının giderek artan sorunlarını hafifletmeye yardımcı olmak için mümkün kılınmaya çalışılıyor.
Organların büyüklüğü ve fizyolojisi de dahil olmak üzere genetik modifikasyon ve klonlamadaki avantajları, çok sayıda yavru üretmesi ve kısa süreli üreme döngüsünden kaynaklı; domuz, insanlar için organ naklinde en uygun hayvanlardan birisidir. Bu konuda yıllarca süren çalışmalar, türler arası nakillerde ki problemlerin çözümünde de oldukça ilerleme kaydetmiş durumda.

Science'da Eylül 2017'de yayımlanan ve aynı zamanda dergiye kapak olan bu çalışmada domuzdan insana yapılabilecek nakillerdeki en önemli sorunlardan biri ortadan kaldırıldı. Bu çalışmada domuz genomundaki domuz endojen retrovirüslerinin (PERV) inaktivasyonu yapılarak, ksenotransplantasyonun güvenliğinin nasıl arttırıldığını göreceğiz. Ksenotransplantasyon, klinik bir gerçek haline gelebilmesi için öncelikle üç ana sorunun çözülmesi gerekir: İmmünolojik red, fizyolojik uyumsuzluk ve insanda hastalığa (zoonoz) neden olan domuz mikroorganizmalarının bulaşma riski.
Türler Arası Organ Naklinde Aşılması Gereken Sorunlar
İlk olarak immünolojik red konusuna bakacak olursak; şuanda gerçekleştirilen organ nakillerinden sonra temelde 3 tip immün red olayı gözlemlenebilir: Hiperakut red, akut red, kronik red. Ayrıca bu red mekanizmalarında önemli olan iki terim söz konusudur: Antijen ve antikor.
Antijen, vücuda girdiğinde bağışıklık sistemi tarafından antikor üretimine yol açan yabancı moleküllerdir. Antijenler, genellikle protein ve polisakkarit yapısında, canlı organizma kısımları ya da büyük moleküllü proteinler ve bunlara bağlanmış karbonhidratlar, nükleik asit veya lipidler şeklindedir.
Antikor ise, bağışıklık sistemi tarafından; kendisine ait olmayan organik yapılara karşı geliştirilen glikoprotein yapısındaki moleküllerdir. Bu moleküller organizmayı, yabancı moleküllerin sebep olabileceği muhtemel zarar verici etkilere karşı erkenden uyararak koruyuculuk sağlar.
Bu bilgiler ışıgında bakacak olursak; hiperakut red (HAR), önceden greftin antijenlerine karşı duyarlı hale gelen bireylerde (kan transfüzyonu, gebelik ve enfeksiyon gibi durumlarla duyarlı hale gelinebilir), transplantasyonu takiben dakikalar ya da saatler (maksimum 72 saat) içinde gelişen bir red reaksiyonudur. Transplantasyon öncesi bu tablonun gelişeceği saptanabilir ve önceden önlenebilir, ancak bu ihtimal hiçbir zaman tam olarak ortadan kaldırılamaz. Burada bizi en çok ilgilendiren ise; hiperakut red geliştiğinde, tedavi şansı da yoktur, acil müdahale edilerek nakledilen organ derhal geri alınır. Hiperakut red, organ geri alınsa dahi hastanın ölümüyle de sonuçlanabilir. Bu nedenle hiperakut red en sık karşılaşılan ve yüksek ölüm oranına sahip bir durumdur.
Hiperakut red, domuz hücreleri ve organları kullanıldığında (ksenotransplantasyon) farklı bir durumla da tetiklenerek karşımıza çıkar. Bu durum insanda, bakteri yüzeyindeki şeker moleküllerini ve aynı zamanda domuz hücrelerini tanıyan (ancak insan hücrelerini tanımayan) ve önceden var olan antikorlar sebebiyle oluşur. Bu antikorlar, birkaç dakika içinde nakil olan organın işlevsiz hale gelmesine yol açabilir. Bu konuya çözüm olarak, bağışıklık reddini (HAR dahil) önlemek için, bu şekerleri ifade etmekten sorumlu enzimde eksikliği olan ve bu organların reddini engelleyen insan proteinlerini ifade eden, genetik olarak modifiye edilmiş domuzlar üretildi.
Diğer bir risk faktörü olan virüsler ve domuzlarda bulunabilen çok sayıdaki diğer mikroorganizmalar, potansiyel olarak domuz hücrelerinin, dokuların ve organların transplantasyonu ile bulaşabilir. Bunlarda Hepatit E virüsü genotipi 3'ün (HEV-3) zoonotik (hayvandan insana bulaşabilen hastalıklar) potansiyeli iyi bilinmesine rağmen, çoğu domuz virüsünün insanları gerçekten enfekte edip zoonoz hastalığa (insanlar ve hayvanların birbirine bulaştırabildikleri ve her iki gruba dahil bireylerde ortak olarak şekillenen hastalıklar) neden olup olmadığı bilinmemektedir.
HEV-3 domuzlardan, az pişmiş domuz eti tüketimi ile hatta temas yoluyla insanlara aktarılır ve en azından bağışıklığı bastırılmış bireylerde ve önceden karaciğer yetmezliği olanlarda kronik enfeksiyona yol açabilir. İnsan sitomegalovirüs (HCMV) bulaşı ise yine insan allotransplantasyonundan (aynı türler arası nakil) sonra gözlemlenmiştir. Tedavi edilmediğinde, HCMV enfeksiyonu, allotransplantın hızlı reddi ile ilişkilidir ve benzer şekilde, domuz CMV'nin, insan dışı primat alıcılardan olan, böbrek nakli gerçirmiş hayvanların hayatta kalmasını, enfekte edilmemiş domuzlardan alınanlara kıyasla azalttığı gösterilmiştir.
Yukarıdaki virüslerden her biri, erken sütten kesme (domuz sütü yoluyla virüs bulaşmasını önlemek için), antiviral ilaçlar, aşılar, sezaryen doğum ve embriyo transferi gibi çeşitli stratejiler kullanılarak domuz donörlerinden arındırılabilir. Bununla birlikte virüs, plasenta vasıtasıyla geçtiğinde (HEV-3'te olduğu gibi) virüslerin ortadan kaldırılma işlemi daha karmaşıktır ve virüs, domuz genomuna entegre olduğunda (örneğin domuz endojen retrovirüsleri) ise virüsü ortadan kaldırmak neredeyse imkansız hale gelir.
Genoma entegrasyon dediğimiz süreç ise endojen retrovirüslerin RNA’larının konak hücrelerin DNA’sına entegre olmasıyla gerçekleşir. Bu, retrovirüslerin isimlerini aldığı ters transkriptaz enzimi tarafından gerçekleştirilir. Bu enzim basitçe RNA molekülünden DNA üreten bir DNA polimeraz enzimidir. Bu enzim sayesinde virüs genomu, konak hücre genomuna entegre olmak için uygun hale gelir. Söz konusu bu virüsü DNA’sında içeren yumurta ve spermin birleşmesiyle oluşan her nesil, organizmanın her hücresine entegre olan ve nesiller boyunca aktarılacak olan endojen retrovirüsü içerir. Nitekim, insanlar dahil olmak üzere tüm memelilerde de endojen retrovirüsler bulunmuştur. Bu da; insanda da nesilden nesile bu virüslerin aktarıldığının bir kanıtıdır.
Endojen retrovirüslere örnek olarak PERV (Porcine endogenous retrovirus) verilebilir. Farklı domuz suşları, hücre başına 3 ila 140 kopya PERV barındırır ve özellikle de PERV- A ve PERV- B tüm domuzlarda bulunur ve birçok başka türde (insan hücreleri de dahil olmak üzere) hücrelere bulaşabilirler. Tersine, PERV- C her canlıda bulunmaz ve sadece domuz hücrelerini enfekte edebilir. PERV- A ve PERV- C'nin rekombinasyonu (2 virüsede ait genetik kod içerme), domuz somatik hücrelerinin genomlarında bulundu, bu durum virüslerin birleşebildiğine işaret ediyordu. Bu tür PERV- A /C rekombinantları insan hücrelerine bulaşabilir ayrıca yüksek replikasyon (çoğalma) hızlarına sahip olmaları açısından da oldukça tehlikelidirler.
PERV'ye özgü ve bu virüse müdahale edebilen özel RNA ifade edebilen transgenik domuzlar ve PERV'ye özgü aşılar da dahil olmak üzere, ksenotransplantasyondan sonra PERV'nin bulaşmasını önleme konusunda birçok strateji geliştirilmiştir. HIV enfeksiyonunun tedavisinde başarılı bir şekilde kullanılan bazı antiretroviral ilaçlar, özellikle integraz inhibitörlerinin de, PERV bulaşımını inhibe ettiği gösterilmiştir.
PERV'leri etkili bir şekilde inaktive etmek için tek araç olan genom modifikasyonu, yaygın olarak tek genleri hedeflemek için kullanılan bir yöntemdir. Bununla birlikte, bazı domuzların 100'den fazla PERV kopyasını taşımaları, genom düzenleme yaklaşımlarını da zorlaştırıyor.
PERV'leri etkisiz hale getirmek için yapılan ilk girişim bir çinko parmak nükleaz kullanılarak gerçekleştirildi. Burada amaç bu yöntemi kullanarak virüse ait genomda kesikler oluşturarak virüsü etkisiz hale getirmekti. Ancak yapılan çalışmada birden fazla hedef dışı bölgelerde oluşan kesikler (off-target) dediğimiz durumla karşılaşıldı. Bu hedef dışı bölgelerde oluşan kesikler de hücreler için ciddi oranda sitotoksik (hücreye toksik şekilde etki edip hücreyi öldürme ya da fonksiyonunu durdurma) etki gösterdi. Ancak bu durum CRISPR-Cas ile aşıldı.
CRISPR-Cas İle Virüsün Etkinliğini Ortadan Kaldırmak
CRISPR-Cas genom düzenleme teknolojisi, şu an oldukça popüler ve genom düzenlemede kullanılan diğer tekniklere göre oldukça başarılı bir teknik. Bu tekniğin ileride Nobel alabilme ihtimali de oldukça yüksek görünüyor.
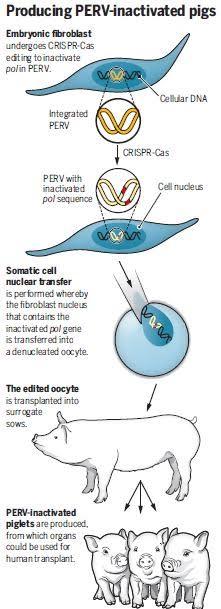 İşte bu başarılı teknik, önceden ölümsüzleştirilmiş domuz hücrelerinde PERV'yi başarılı bir şekilde inaktif hale getirmeyi mümkün kıldı. Yapılan çalışmada bilim insanları hücrelerdeki tüm PERV'leri inaktive ederek canlı, sağlıklı, genetik olarak modifiye edilmiş domuzlar üretmeyi başardılar.
İşte bu başarılı teknik, önceden ölümsüzleştirilmiş domuz hücrelerinde PERV'yi başarılı bir şekilde inaktif hale getirmeyi mümkün kıldı. Yapılan çalışmada bilim insanları hücrelerdeki tüm PERV'leri inaktive ederek canlı, sağlıklı, genetik olarak modifiye edilmiş domuzlar üretmeyi başardılar.
Bu deney için kullanılan domuz suşu normal olarak PERV- A ve PERV- B'nin 25 kopyasını taşır. Polimerazların üretiminden sorumlu gende, yüksek oranda korunmuş bir bölgede, ters transkriptaz kodlayan bir inaktive edici mutasyonun başlatılması için CRISPR-Cas'ın kullanılmasıyla, primer hücrelerdeki tüm PERV’ler inaktive edildi ve böylelikle de virüse ait bulaşıcı partiküllerin üretimi de engellenmiş oldu.
Bu hücrelerin çekirdekleri, somatik hücre çekirdek transferi (çekirdeği çıkarılmış olan bir yumurta hücresine somatik bir hücre çekirdeğinin transferi ile yeni bir hücreden yapay bir embriyonun oluşturulmasıdır. Böyle bir embriyodan oluşturulan canlı, somatik hücre elde edilen canlının klonu (özdeşi) olur ) yöntemiyle çekirdeği çıkarılmış, PERV - C virüsüyle öncesinde karşılaşmamış, PERV’nin ise çok az sayıda kopyasını taşıyan domuzlara aktarıldı ve bu domuzların çiftleştirilmesinden sonra yeni embriyolar üretildi. Bu şekilde geliştirilen 17 yavru domuzda, PERV inaktive olduğu tespit edildi. Daha sonrasında bu domuzlardan 15’i hayatta kalabildi. Domuzlardan en yaşlı ve en sağlıklı olanı çalışma yayınlandığında dört aylıktı.
PERV'lerin insanları gerçekten (kültürde insan hücrelerine bulaşabilmelerine rağmen) bulaşıp bulaşamayacakları ve immün yetmezlik veya kanser gibi retrovirüslerin tetiklediği hastalıklara neden olup olmadıkları belli olmamasına rağmen, bu yeni başarı, ksenotransplantasyondan sonra PERV enfeksiyonu korkularını ortadan kaldıracaktır. Bu durum, ksenotransplantasyonun klinik uygulamasında ileri bir adımdır. Bununla birlikte, diğer sorunlar (bağışıklık reddi, fizyolojik uyumluluk ve diğer potansiyel zoonotik virüslerin ortadan kaldırılması) çözülmelidir.
Öte yandan, çalışmayı yapan grup, farklı bir konuda da çok ilginç bir bilgiye ulaştılar. Araştırmada, insanlar da dahil olmak üzere çok sayıda türde, endojen retrovirüslerin zarf proteinlerinin plasentanın oluşumunda önemli bir rol oynadığı fark edildi.
Syncytin olarak bilinen bu proteinler plasentada syncytiotrophoblast (plesentayı koruyan dış tabakalardan biri) oluşumuna yardımcı olur ve bağışıklık baskılayıcı özelliklere sahip olabilirler. İmmün sistem plesentaya karşı immünolojik tolerans gösterir. Böylece annenin bağışıklık sistemi bebeği yabancı algılayıp ona zarar vermez. İşte bu noktada bu proteinin bağışıklık baskılayıcı özelliğe sahip olması, viral proteinin bu süreçte aktif rol aldığının bir göstergesi olabilir. Genetik olarak tasarlanmış domuzların sağlıklı bir şekilde doğuşu ise, ya ters transkriptazın bozulmasının zarf proteinlerinin işlevini etkilemediğini ya da domuzlarda plasenta oluşumunda retroviral zarf proteinleri gerektirmediğini gösterir.
- Advances in organ transplant from pigs. Science, (2017). http://science.sciencemag.org/content/357/6357/1238
- Inactivation of porcine endogenous retrovirus in pigs using CRISPR-Cas9. Science, (2017). http://science.sciencemag.org/content/357/6357/1303
- Kansu, E. "Kök Hücreleri ve Klonlama." http://www.21yyte.org/assets/uploads/files/041-50%20Emin%20Kansu.pdf (accessed October 6, 2017).
Dilediğiniz miktarda aylık veya tek seferlik bağış yapabilirsiniz.
Destek OlBunlar da İlginizi Çekebilir