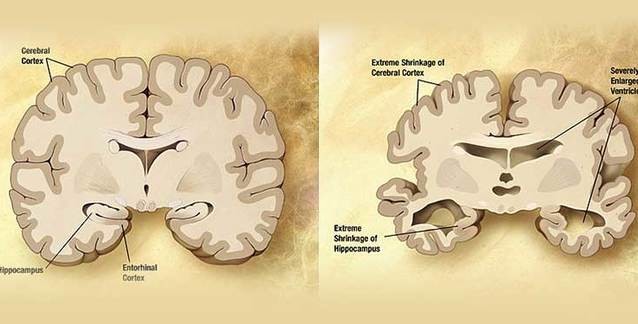
Alzheimer hastalığının çok büyük bir oranda, sinir hücrelerinin arasındaki sinaptik boşluklarda ve beyindeki boşluklarda bir araya gelerek biriken amiloid beta ve tau proteinlerinden kaynaklandığını, en azından en son tahlilde bu olgunun Alzheimer hastalığının gelişimi ve semptomlarının görülmesine neden olduğunu biliyoruz.
Birçok protein, kendisi ile yüksek konsantrasyonlarda aynı ortamda bulunduğunda birleşerek çok sayıda üyesinin bir araya gelmesi ile küresel yumaklar halini alabilir. Oligomer adı verdiğimiz bu birikim proteinlerinin yanı sıra iğnemsi amiloid lifleri de bir araya gelerek birbirleri ile bağ kurarak plaklar halini alabilmektedir.
Bu protein agregasyonları birçok hastalığa sebep olabilir. Bunlardan birisi olan Alzheimer hastalığının da amiloid-β (Aβ) peptitleri yani proteinlerinin kendileri ile birleşmesi sonucu oluşan oligomerler ve amiloid lifleri dolayısıyla ortaya çıktığı ve gelişimini sürdürdüğü biliniyor.
Amiloid proteinlerinin birikimi hücre zarı gibi hidrofilik / hidrofobik arayüzlerin çevresinde hızlanmaktadır. Ancak bunun gerçek sebebinin ne olduğu henüz iyi derecede bilinmiyor.
Exploratory Research Center on Life and Living Systems ve Japonya'daki Institute for Molecular Science'tan araştırma ekipleri moleküler dinamik simülasyonları ve nükleer manyetik rezonans spektroskopi deneyleri ile bu noktayı anlamaya çalıştı. Bulgulara göre, amiloid peptitlerinin hidrofilik/hidrofobik yüzeylerde ve arayüzlere yakın yerlerde hızla bir araya gelme eğiliminde olduğu tekrar görüldü.
Bunun temel sebebinin ise amiloid betaların, bahsi geçen arayüzlerin etrafında, su çözeltilerinde olduğundan daha çok bulunmalarından kaynaklandığı gösterildi. Buna ek olarak β iğneciklerinin aşağıdaki görselde görüleceği gibi amiloid beta peptitlerinin yapısal olarak düz biçimde esneyebildikleri ve molekül içi hidrojen bağları kurabildiği gözlemlendi.
Tüm bunlar olurken bu eğilimdeki bir amiloid beta proteinin yanına kendi gibi bir esneyen amiloid beta proteini geldiğinde diğer ile birleşerek, birikmeye sebep olduğu ve bunu yeni hidrojen bağları kurarak bu süreci daha da uyarıp kolaylaştırdığı gösterildi.
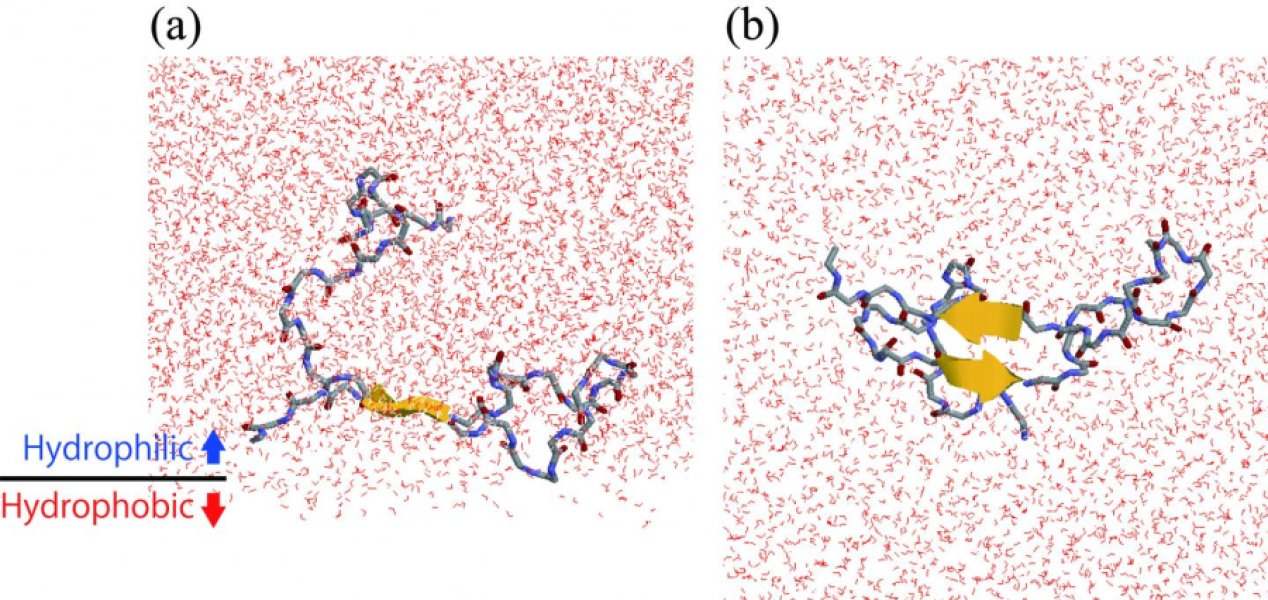 Görselin (a) kısmında amiloid beta proteinin, hücre zarı benzeri hidrofilik/hidrofobik bir panel üzerinde esneyerek saç iğnesi bir benzeri yapıyı oluştururken görülüyor. (b) kısmında ise panele alttan bakıldığında proteinin şeklinin uzun biçimde görüldüğü kaydedilmiş. Telif: ExCELLS/IMS
Görselin (a) kısmında amiloid beta proteinin, hücre zarı benzeri hidrofilik/hidrofobik bir panel üzerinde esneyerek saç iğnesi bir benzeri yapıyı oluştururken görülüyor. (b) kısmında ise panele alttan bakıldığında proteinin şeklinin uzun biçimde görüldüğü kaydedilmiş. Telif: ExCELLS/IMS
Bu şekilde hücre zarı etrafında daha yoğun olmalarının amiloid beta birikiminin tek nedeni olmadığı aynı zamanda intramoleküler sebeplerinin olduğu ortaya koyulmuş oldu.
Böylelikle sinir hücrelerinin aralarındaki boşluklarda yani sinapslarda (elbette bu sinapslar hücre zarına yani hidrofilik/hidrofobik özellikleri olan arayüzlere yakın alanlar olduğundan) neden çokça biriktiği büyük ölçüde açıklanmış oldu. Bu da tedavi için farklı güzergahların hedef seçilebileceğini gösteriyor.
Birçok protein, kendisi ile yüksek konsantrasyonlarda aynı ortamda bulunduğunda birleşerek çok sayıda üyesinin bir araya gelmesi ile küresel yumaklar halini alabilir. Oligomer adı verdiğimiz bu birikim proteinlerinin yanı sıra iğnemsi amiloid lifleri de bir araya gelerek birbirleri ile bağ kurarak plaklar halini alabilmektedir.
Bu protein agregasyonları birçok hastalığa sebep olabilir. Bunlardan birisi olan Alzheimer hastalığının da amiloid-β (Aβ) peptitleri yani proteinlerinin kendileri ile birleşmesi sonucu oluşan oligomerler ve amiloid lifleri dolayısıyla ortaya çıktığı ve gelişimini sürdürdüğü biliniyor.
Amiloid proteinlerinin birikimi hücre zarı gibi hidrofilik / hidrofobik arayüzlerin çevresinde hızlanmaktadır. Ancak bunun gerçek sebebinin ne olduğu henüz iyi derecede bilinmiyor.
Exploratory Research Center on Life and Living Systems ve Japonya'daki Institute for Molecular Science'tan araştırma ekipleri moleküler dinamik simülasyonları ve nükleer manyetik rezonans spektroskopi deneyleri ile bu noktayı anlamaya çalıştı. Bulgulara göre, amiloid peptitlerinin hidrofilik/hidrofobik yüzeylerde ve arayüzlere yakın yerlerde hızla bir araya gelme eğiliminde olduğu tekrar görüldü.
Bunun temel sebebinin ise amiloid betaların, bahsi geçen arayüzlerin etrafında, su çözeltilerinde olduğundan daha çok bulunmalarından kaynaklandığı gösterildi. Buna ek olarak β iğneciklerinin aşağıdaki görselde görüleceği gibi amiloid beta peptitlerinin yapısal olarak düz biçimde esneyebildikleri ve molekül içi hidrojen bağları kurabildiği gözlemlendi.
Tüm bunlar olurken bu eğilimdeki bir amiloid beta proteinin yanına kendi gibi bir esneyen amiloid beta proteini geldiğinde diğer ile birleşerek, birikmeye sebep olduğu ve bunu yeni hidrojen bağları kurarak bu süreci daha da uyarıp kolaylaştırdığı gösterildi.
 Görselin (a) kısmında amiloid beta proteinin, hücre zarı benzeri hidrofilik/hidrofobik bir panel üzerinde esneyerek saç iğnesi bir benzeri yapıyı oluştururken görülüyor. (b) kısmında ise panele alttan bakıldığında proteinin şeklinin uzun biçimde görüldüğü kaydedilmiş. Telif: ExCELLS/IMS
Görselin (a) kısmında amiloid beta proteinin, hücre zarı benzeri hidrofilik/hidrofobik bir panel üzerinde esneyerek saç iğnesi bir benzeri yapıyı oluştururken görülüyor. (b) kısmında ise panele alttan bakıldığında proteinin şeklinin uzun biçimde görüldüğü kaydedilmiş. Telif: ExCELLS/IMSBu şekilde hücre zarı etrafında daha yoğun olmalarının amiloid beta birikiminin tek nedeni olmadığı aynı zamanda intramoleküler sebeplerinin olduğu ortaya koyulmuş oldu.
Böylelikle sinir hücrelerinin aralarındaki boşluklarda yani sinapslarda (elbette bu sinapslar hücre zarına yani hidrofilik/hidrofobik özellikleri olan arayüzlere yakın alanlar olduğundan) neden çokça biriktiği büyük ölçüde açıklanmış oldu. Bu da tedavi için farklı güzergahların hedef seçilebileceğini gösteriyor.
Kaynak ve İleri Okuma
- Satoru G. Itoh, Maho Yagi-Utsumi, Koichi Kato, Hisashi Okumura. Effects of a Hydrophilic/Hydrophobic Interface on Amyloid-β Peptides Studied by Molecular Dynamics Simulations and NMR Experiments. The Journal of Physical Chemistry B, 2018; DOI:" https://pubs.acs.org/doi/10.1021/acs.jpcb.8b11609
Etiket
Projelerimizde bize destek olmak ister misiniz?
Dilediğiniz miktarda aylık veya tek seferlik bağış yapabilirsiniz.
Destek Ol
Yorum Yap (0)
Bunlar da İlginizi Çekebilir
16 Ekim 2014
2014 Kimya Nobel Ödülü
12 Ağustos 2019
Beyin, Toksin ve Atıklarından Nasıl Arınır?

29 Haziran 2015
Alzheimer'a 18 Yıl Erken Teşhis !

19 Temmuz 2016
Yeni Alzheimer Aşısı, Grip Aşısı Kadar Yaygınlaşabilir

08 Haziran 2015
Alzheimer'ın kökeni insan zekasına bağlandı
01 Nisan 2016
Alzheimer Tedavisinde Umut Verici Gelişme