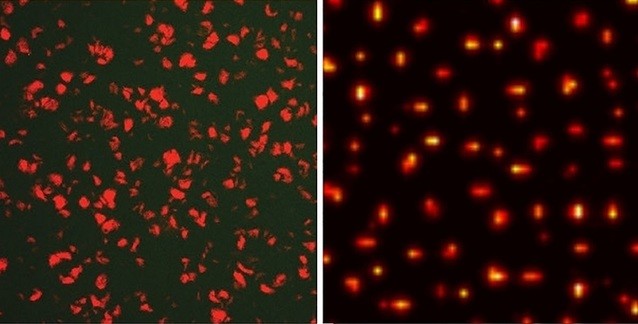
Hayvan kas dokularındaki, memelilerde doğal olarak bulunan myoglobin proteininin ekspresyon (ifadelenme) seviyeleri (genlerden protein sentezlenmesi) ve E. Coli ( Escherichia coli )'nin ekspresyon seviyeleri farklıdır. Bu farklılık ve çeşitliliği incelemek üzere, Houston'daki Rice University'den araştırmacılar The Journal of Biological Chemistry'da yayımlanan bir çalışmada, holoMyoglobin proteinin ekspresyonunu belirleyen faktörlerin sayısal (niceliksel) analizlerini gerçekleştirmek üzere buğday embriyosunda translasyon (çevrim; mRNA'ya göre tRNA sentezi) tahlili ve in vitro (laboratuvar ortamında tüpte) transkripsiyon (yazım; ilgili gen için DNA'dan mRNA yapımı) uygulandı.
Araştırmacılar kontrollü bir karşılaştırma yapabilmek için, iki kara ve dört derin-dalgıç olan su memelisinde doğal olarak bulunan myoglobin proteinleri ve üç ayrı mutant* (aynı proteinin bir histidin aminoasiti için mutant versiyonu) canlının proteinleri ile ilgili bilgilerle (yapısal ve dizilimsel) kütüphane oluşturuldu.
Hücre dışı ve canlı vücutta ayrı ayrı gerçekleşen süreçlerde holo-myoglobin (ve mutantları) çeşitlerinin ekspresyon seviyeleri ile apoglobin kararlılıkları arasında birbirine paralel bir ilişki tespit edildi. Araştırmanın sonuçları niceliksel olarak derinlere dalabilen memelilerin, kara canlıları ile karşılaştırıldığında kararlı myoglobin çeşitlerini daha yüksek seviyelerde bulundurduğunu gösteriyor. Aynı sebepten ötürü balinaların etlerinin çok koyu renkli olduğu da biliniyor.
Araştırmacılar tarafından gerçekleştirilen teorik analizde ise, son protein şeklini almamış (unfolded) apomyoglobin protein birikiminin yüksek oranda görüldüğü noktalarda holomyoglobin ve diğer demir içeren kan proteinlerinin ekspresyon seviyelerinde düşüklük gözlemlendi.
Mutant ve normal proteinlerin, çeşitlerinin ve apo hallerinin tüm canlı içi ve dışı gen ekspresyonu ve ara süreçleri verileri ileri araştırmalarda daha kullanılabilir bir sentetik kan üretimini sağlayabilecek bilgiler elde edildi. Myoglobin, yapısal çeşitleri ile en verimli üretimin gerçekleştirilmesini kolaylaştıracak gibi görünüyor.
Mutant* - Buradaki mutasyonun oluşturulma amacı son halini almamış (apoglobin) globin proteinini kararlı kılmak - quaternery yapı denen son protein şeklinin oluşmasını - engellemektir.
Kaynak : Protein Structure and Folding - Molecular Biophysics - Papers of the Week:Stability of Myoglobin Influences Its Expression Level♦: Apoglobin Stability Is the Major Factor Governing both Cell-free and in VivoExpression of HolomyoglobinJ. Biol. Chem. 2015 290: 23496. doi:10.1074/jbc.P115.672204
Araştırmacılar kontrollü bir karşılaştırma yapabilmek için, iki kara ve dört derin-dalgıç olan su memelisinde doğal olarak bulunan myoglobin proteinleri ve üç ayrı mutant* (aynı proteinin bir histidin aminoasiti için mutant versiyonu) canlının proteinleri ile ilgili bilgilerle (yapısal ve dizilimsel) kütüphane oluşturuldu.
Hücre dışı ve canlı vücutta ayrı ayrı gerçekleşen süreçlerde holo-myoglobin (ve mutantları) çeşitlerinin ekspresyon seviyeleri ile apoglobin kararlılıkları arasında birbirine paralel bir ilişki tespit edildi. Araştırmanın sonuçları niceliksel olarak derinlere dalabilen memelilerin, kara canlıları ile karşılaştırıldığında kararlı myoglobin çeşitlerini daha yüksek seviyelerde bulundurduğunu gösteriyor. Aynı sebepten ötürü balinaların etlerinin çok koyu renkli olduğu da biliniyor.
Araştırmacılar tarafından gerçekleştirilen teorik analizde ise, son protein şeklini almamış (unfolded) apomyoglobin protein birikiminin yüksek oranda görüldüğü noktalarda holomyoglobin ve diğer demir içeren kan proteinlerinin ekspresyon seviyelerinde düşüklük gözlemlendi.
Mutant ve normal proteinlerin, çeşitlerinin ve apo hallerinin tüm canlı içi ve dışı gen ekspresyonu ve ara süreçleri verileri ileri araştırmalarda daha kullanılabilir bir sentetik kan üretimini sağlayabilecek bilgiler elde edildi. Myoglobin, yapısal çeşitleri ile en verimli üretimin gerçekleştirilmesini kolaylaştıracak gibi görünüyor.
Mutant* - Buradaki mutasyonun oluşturulma amacı son halini almamış (apoglobin) globin proteinini kararlı kılmak - quaternery yapı denen son protein şeklinin oluşmasını - engellemektir.
Kaynak : Protein Structure and Folding - Molecular Biophysics - Papers of the Week:Stability of Myoglobin Influences Its Expression Level♦: Apoglobin Stability Is the Major Factor Governing both Cell-free and in VivoExpression of HolomyoglobinJ. Biol. Chem. 2015 290: 23496. doi:10.1074/jbc.P115.672204
Kaynak ve İleri Okuma
Etiket
Projelerimizde bize destek olmak ister misiniz?
Dilediğiniz miktarda aylık veya tek seferlik bağış yapabilirsiniz.
Destek Ol
Yorum Yap (0)
Bunlar da İlginizi Çekebilir
24 Aralık 2014
Laboratuvarda Organ Üretimi Mümkün Olabilir

28 Haziran 2015
Gezegen Kolonileşmesinde İlk Durak Mars
01 Temmuz 2015
Gerçek İşlevli Yapay Nöron Üretildi

28 Aralık 2017
Farklı Biyomürekkep Karışımları ile Büyütülen Organlar

09 Eylül 2018
3D Yazıcıdan Elde Edilen Prototip Biyonik Göz