Enzimlerin işleyişinde kuantum tünelleme nasıl bir rol oynar? Kuantum tünellemede, bir parçacık klasik fizik yasalarına göre geçemeyeceği kadar yüksek bir engeli aşabilir. Bilimciler kimya ve biyolojide tünellemenin rol oynadığı çeşitli süreçleri zaten bir süredir biliyorlar; özellikle de hidrojen atomları gibi küçük parçacıkların aktarımıyla ilgili olan çok sayıda tepkimede tünellemenin payı var. Ayrıca Taramalı Tünelleme Mikroskobu ve yarı-iletken tünel diyot gibi modern cihazlar da önemli uygulama alanları arasında sayılabilir.
Ancak enzimlerle ilgili bazı deneysel gözlemler, enzimlerin işin içine girdiği kimyasal tepkimelerde kuantum tünelleme modellerinin yetersiz kaldığına işaret ediyordu. Bu da akla, enzimlerin bir şekilde tünellemenin özel bir biçimde gerçekleşmesini sağlayabileceğini getirdi; dolayısıyla enzimlerin nasıl işlediği konusunda yeni modellere gereksinim olduğu düşünülmeye başladı. Acaba enzimleri anlamamızı sağlayacak kuramsal araçlar elimizde miydi, yoksa yeni modellere ve kavramlara mı gerek vardı?
2012 yılında Nature Chemistry dergisinde yayımlanan bir çalışmada, Bristol Kimya Okulu'ndan Dr. David Glowacki, Prof. Jeremy Harvey ve Prof. Adrian Mulholland'dan oluşan ekip basit bir matematik kullanarak, kuantum tünellemeyi tanımlayan standart modellerin, enzimlerin çok sayıda olası farklı yapılar arasında çalkalanmakta olduğu gerçeği hesaba katıldığında, deneysel enzim verilerini açıklayabildiğini göstermişti.
Enzimler, tüm proteinler gibi sürekli olarak birbirinden azıcık farklı biçimlere girip çıkar. Ama yapıları azıcık farklılaşırken, katalitik özellikleri önemli ölçüde farklı hâle gelebilir. Proteinlerin dinamik yapılarına, protein katlanması üzerinde çalışan bilimciler tarafından da dikkat çekilmişti. Bristol araştırmacılarının makalesi, enzimlerin bu yapısal çalkalanmalarının çok önemli olduğunu ve modellemeye dahil edildiği takdirde enzimlerin işleyişini açıklayabileceklerini vurgulamıştı. Deneyler ve bilgisayar simülasyonları yardımıyla, konu üzerinde çalışmalar sürüyor.
Enzimler ve Enerji Profili Değişimi
Enzimler nasıl çalışır? Olağan kimyasal tepkimeleri hızlandıran maddeler olan katalizörler, tepkimeye katılmaksızın ya da değişmeksizin tepkime hızını artırır. Enzimler de esasında inorganik katalizörlerden farklı değildir. Katalizörler farklı mekanizmalarla çalışır ama bu mekanizmaların çoğu, katalizörlerin tepkimeleri nasıl hızlandırdığına basit bir açıklama sunan Geçiş Durumu Kuramı (GDK) yoluyla anlaşılabilir.
GDK'yı anlamak için meseleye önce başka bir taraftan bakıp, tepkimeleri hızlandırmak için neden katalizörlere gereksinim olduğunu düşünmekte fayda var. Bunun nedeni, yaşadığımız ortamdaki kimyasal maddelerin çoğunun oldukça kararlı olması, yani tepkimeye girmeye elverişli olmamasıdır. Bu maddeler ne kendiliğinden parçalanır ne de diğer kimyasallarla reaksiyona girer; zaten aksi olsaydı, bugün ortamda bu kadar yaygın bulunmazlardı.
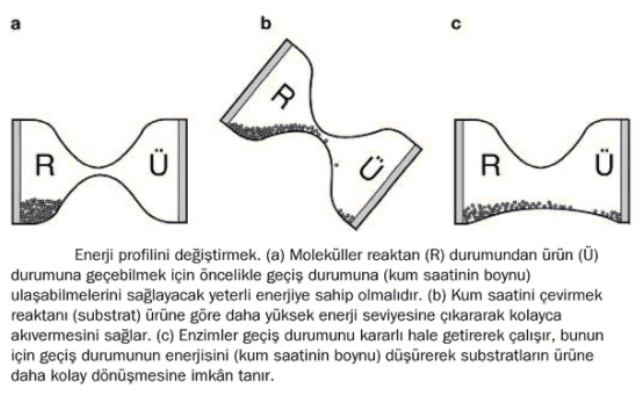
Yaygın kimyasalların kararlı olmasının nedeni, yapılarındaki bağların, madde içinde kaçınılmaz olarak varolan moleküler türbülans tarafından parçalanmamasıdır. Reaktan moleküllerin ürünlere dönüşebilmesi için aşması gereken tepeler vardır. Bu tepeleri aşmalarını sağlayacak enerji, ısı biçiminde verilebilir. Yiyecekleri pişirdiğimizde, kısa sürede tatlarında oluşan değişikliğin temelinde de bu gerçek vardır. Isının kimyasal tepkimeleri nasıl hızlandırdığını gözünüzde canlandırmak için reaktan moleküllerini yan yatmış bir kum saatinin solundaki cam haznede bulunan kum taneleri olarak düşünelim. Kendi hâline bırakılırsa, kum taneleri hep orada kalır çünkü tanecikler kum saatinin boynuna ulaşıp, tepkimenin nihai ürünlerini temsil eden sağ hazneye geçecek enerjiye sahip değildir. Reaktan molekülleri ısıtarak, hareketliliklerini yani enerjilerini artırabilir ve ürüne dönüşmelerini sağlayabiliriz.
Reaktanları ürüne dönüştürmenin bir başka yolu ise moleküllerin aşması gereken enerji engelini aşağıya çekmektir. İşte katalizörler bunu yapar. Bu benzetmede kum saatinin boynunu genişletmeye karşılık gelen bir işlev üstlenerek, sol haznedeki kumun az bir ısıl uyarımla sağ hazneye aktarılabilmesini sağlar. Katalizörlerin enerji profilini bu şekilde değiştirebilme becerisi, substratların ürüne çok daha hızlı dönüşmesini sağlayarak tepkimeyi büyük ölçüde hızlandırır.
Kollajenaz Enzimi
Geçiş durumu kuramına göre, katalizörler peptid bağının kırılması gibi kimyasal olayları, geçiş durumunu daha kararlı hâle getirerek, dolayısıyla nihai ürünlerin oluşma şansını artırarak hızlandırır. Örneğin kollajenaz enzimi adlı molekül, kollajen lifinin üzerine bir istiridye gibi kapanır ve lif boyunca kayarak ilerlerken, üçlü sarmal yapıyı bir fermuar gibi açar. Ardından da amino asitler arasındaki bağları keser. Milyonlarca yıl boyunca sağlam kalabilecek protein zincirini ânında parçalar. Etrafındaki moleküllerin gelişigüzel itiş-kakışının tersine, enzim, kollajen life sarılarak, zarif ve kesin bir moleküler dansla lifin sarmalını çözer ve zincir üzerindeki iki amino asit arasında bulunan peptid bağını kestikten sonra sarıldığı yerden ayrılıp, bir sonraki peptid bağına doğru ilerler.
Söz konusu kesme işlemine daha yakından bakmak için enzimin, protein zincir ile tek bir su molekülünden oluşan substratları yerinde tutan çene benzeri yarığına girelim. Burası enzimin "aktif bölge"sidir; yani enerji kum saatinin boynunu eğip bükerek, peptid bağlarının parçalanmasını hızlandıran işlevsel kısmıdır. Bu moleküler yönetim merkezinde gerçekleşen koreografi, dışarıda ve enzimin etrafındaki bütün o gelişigüzel itiş-kakıştan çok farklıdır.
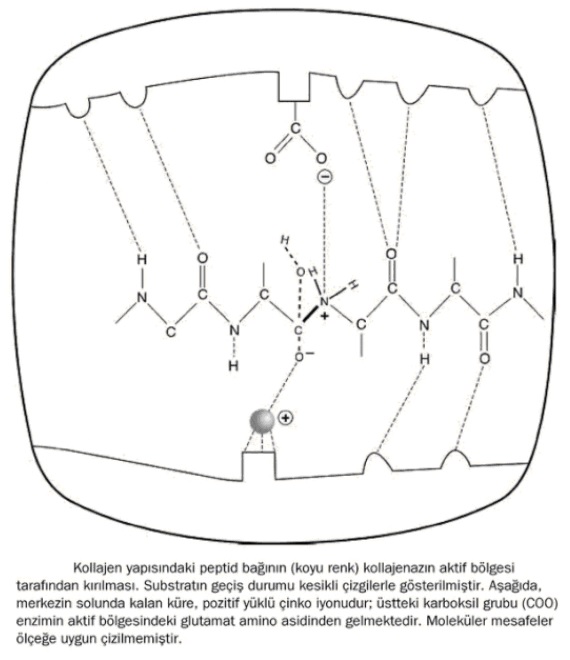
Enzim, peptid bağını, kırılmadan öne ulaşılması gereken kararsız geçiş durumunda tutar. Şekilde noktalı çizgilerle gösterilen ve aslında substrat ile enzim arasında ortaklaşılan elektronlardan ibaret olan zayıf kimyasal bağlar, subsratları yerinde tutar. Böylece substratlar, enzimin moleküler çeneleri tarafından doğranmaya hazır bir konfigürasyondan tutulur.
Enzim, çeneleri kapanırken bağı "ısırmak"tan çok daha incelikli bir şey yapar: Katalizin gerçekleşebileceği araçları sağlar. Yerleşen, hedefteki peptid bağının tam altında, pozitif yüklü büyük bir atom dikkatimizi çeker. Bu, pozitif yüklü çinko atomudur. Eğer enzimin aktif bölgesini onun çeneleri olarak düşünürsek, çinko iki kesici dişten biridir. Pozitif yüklü atom, substratlardaki oksijenden bir elektronu çekip, geçiş durumunu kararlı hâle geirir ve böylece enerji profilini değiştirir. Artık kum saatinin boynu genişlemiştir.
İşin geri kalanını, enzimin ikinci moleküler kesici dişi halleder. Bu kesici, enzimin kendi amino asitlerinden biri olan ve negatif yüklü oksijen atomu hedef peptid bağının üzerinde gelecek şekilde konumlanan glutamattır. Görevi, ilk olarak bağlı su molekülünden pozitif yüklü bir proton koparmaktır. Ardından bu protonu, hedefteki peptid bağının bir ucundaki azot atomuna aktararak, ona bir pozitif yük kazandırır ki bu, peptid bağındaki elektronları çeker. Elektronlar kimyasal bağların tutkalı gibidir. Dolayısıyla, elektronu bağdan çekip çıkarmak, ek yerinin zayıflayıp kırılmasına neden olur. Birkaç elektronun daha yeniden düzenlenmesinin ardından, tepkimenin ürünleri olan kırık peptid zincirleri enzimin moleküler çenelerinden dışarı atılır. Böylece, başka türlü milyonlarca yıl sonra gerçekleşebilecek bir tepkime nanosaniyeler içinde tamamlanır.
McFadden ve Al-Khalili, "Kuantum Sınırında Yaşam" adlı kitaplarında enzimlerin, insan yapımı makinelerin (yani moleküler düzeyde işleyişleri, gelişigüzel hareket eden trilyonlarca parçacığın bilardo topu benzeri kaotik hareketinden kaynaklanan makinelerin) minyatür biçimleri olmadığının altını çiziyor. Doğanın bu nano-makinelerinin, moleküler düzeyde, milyonlarca yıllık doğal seçilimin titiz mühendisliğinden, maddenin temel parçacıklarının hareketini yönlendirmek için geçmiş ve koreografisi dikkatle planlanmış bir dans sergilediklerini belirtiyor.
Fakat laktoz-galaktosidaz hikâyesinin asıl ilginç kısmı şudur: Birkaç yıl önce Barry Hail adında bir araştırmacı galaktosidaz enzimini yapan genin kimyasal olarak “silindiği” bir deney yaptı; böylelikle şimdi bakteriler artık laktozu sindirmek için gerekli enzimi yapamayacaklardı. Sonra bu değiştirilmiş bakterileri, bu bakterilerin artık sindiremeyecekleri laktozu içeren bir ortama koydu ve bakterilerin birçok nesil boyu kendi başlarına üremelerine izin verdi. Ve bir zaman süreci (birçok bakteri nesli) sonucunda bir kez daha laktozu sindirebilen mutasyona uğramış bazı bakteri suşları (soyları) ortaya çıktı. Fakat Hail gerekli enzimin üretimi için gerekli geni bütünüyle çıkardığı halde bu nasıl olabilmişti?
Bu bariz “gizemin” yanıtını, biyokimyasal düzeydeki bazı önemli evrimsel mekanizmaları açıklamaktadır. Her şeyden önce, bakteriler üredikçe, canlı organizmaların her ürediğinde görülen (rastlantısal, önceden belirlenmiş yönlerde ilerlemeyen) olağan, tesadüfi genetik “kopyalama hataları”na bağlı olarak birbiri ardına nesillerde küçük genetik mutasyonlar görülmeye başladı. Bir noktada bu tesadüfi mutasyonlar ilk etapta galaktosidaz enzimini üretmiş olan genden farklı bir gende olmuş bulundu. Fakat bu mutasyon şimdi bu farklı genin laktozu sindiren enzimi üretmeye başlamasına izin veriyordu! Bu yüzden şimdi mutasyona uğramış bu bakteriler bir kez daha laktozu yiyebiliyordu. İlave olarak, mutasyona uğramış bu suşlardaki en azından bazı bireyler içinde, eksik enzimi üretmeye başlamış olan mutant geni kontrol eden düzenleyici gende “ilave” bir mutasyon daha görüldü. Şimdi düzenleyici gen öyle bir şekilde değişmişti ki, bakterinin ortamında laktozun mevcut olup olmamasına bağlı olarak bir kez daha enzimin (açma-kapama düğmesini) üretimini devreye sokup çıkartabiliyordu. Ve sonra üçüncü bir değişim gerçekleşti: Birkaç nesil sonra, farklı bir şeker ortamında gelişmiş bu mutant bakteri soylarının bazıları, bakterilerin dış ortamlardan laktoz almasını daha da kolaylaştıran bakteri hücre çeperlerindeki bir proteinin üretimini (lac-permeaz olarak bilinir) devreye sokup çıkaran, mutasyona uğramış ilave soylar evrimleştirmeye başlamıştı (yine organizmalar ürerken daima gerçekleşen basit rastlantısal mutasyonlar yoluyla). Bu mutasyonların üçünü de geçirmiş bakterilerin laktoz besin kaynağına sahip bulunan herhangi bir ortamda ne kadar başarılı üreyeceklerini hayal edin!
Bu yolla, ilk etapta hiç laktoz yiyemeyen canlı organizma toplumlarının birçok nesil boyunca bu yiyecek kaynağından kolaylıkla ve etkin şekilde faydalanabilen bakteri toplumlarına nasıl evrildiğini görebilirsiniz. Ve (laktoz içeren bir ortamda laktoz sindirme kapasitesini geliştirmiş bulunan bakteri soyları laktoz yiyemeyenlere göre daha fazla altsoy üreteceği, bu da bu evrimsel modifikasyonların nesiller boyu doğal yayılımıyla sonuçlanacağı için) bu evrimsel süreç tesadüfi mutasyonların tamamen doğal ve bütünüyle yönlendirilmemiş ve önceden yazılmamış bileşimini tesadüfi olmayan doğal seçilim yoluyla ayıklamıştır. Evrimsel biyolog Doug Futuyma’nın özetlediği (ve Miller’in kitabı Finding Darwin’s God’da alıntılandığı) gibi, “Böylelikle enzim sisteminde, substrate hidrolizini mümkün kılan enzim yapısındaki değişimleri, enzimin substrata karşılık sentezlenebilmesi için düzenleyici bir genin değişimini ve substratın girişi için gereksinim duyulan permeaz’ı başlatan (indükleyen) bir enzim reaksiyonunun gelişmesine olanak sağlayan değişimlerden oluşan bütün bir laktoz kullanım sistemi evrimleşmiştir." Mutasyon ve doğal seçilimin birlikte uyumlanarak karmaşık adaptasyonların kaynağı olduğu yolundaki yeni-Darvinci ilkenin daha iyi bir örneklenmesi istense bile bulunamazdı.
Miller, bunun tam olarak akıllı tasarım yaratılışçısı Michael Behe’nin genellikle “indirgenemeyecek karmaşıklık” olarak düşündüğü (ve bu nedenle kendi başına evrimleşebileceğine inanmadığı) tipte, gerçekten karmaşık, çok parçalı biyokimyasal bir sistem olduğunu işaret etmektedir. Bu tarz bir sisteme bakış şekli düşünülünce, Behe büyük olasılıkla bütün parçaları aynı zamanda mevcut olmadan düzgün şekilde işlev göremeyeceğini iddia edecektir. (Çünkü Behe’nin görüşüne göre, laktozu sindirmek için gerekli galaktosidaz enzimi hâlihazırda mevcut olmadığı takdirde, laktozun bakteriye girmesine yardımcı olan protein işe yaramayacak; bu enzim de laktoz ortamda mevcut olduğunda onu devreye sokacak düzenleyici genin yokluğunda bir işe yaramayacak ve devreye sokup çıkaracakları enzimler ilk etapta orada olmadığı takdirde de bu düzenleyici genler de işe yaramayacaktır.) Böylesine çapraşık, çok parçalı biyokimyasal bir sistem tam olarak Behe’nin zaman sürecine yayılmış ayrı aşamalar halinde asla evrimleşemeyeceğini düşündüğü tipte bir şeydir. Ve Behe bunun bir tür akıllı tasarımcının işe dâhil olduğunun bir “kanıtı” olduğunda ısrar etmektedir. Fakat şimdi verdiğimiz örnek böylesine karmaşık, çok parçalı biyokimyasal bir sistemin aslında bütünüyle doğal şekilde ve tümüyle kendi başına, zaman içine yayılmış birtakım aşamalarla evrimleştiğinin doğrudan kanıtıdır. Ken Miller’in bu somut örnekle ilgili sözlerini bitirdiği gibi: “Bunun önceden tasarlanmamış olduğunu biliyoruz. Evrimleştiğini biliyoruz, çünkü laboratuvarın içinde oluşumunu izledik!”
Özet olarak, günümüzde birçok canlı hücrede mevcut olan çeşitli karmaşık biyokimyasal sistemlerin tedrici olarak, daha farklı, basit ama yine de işlevsel, daha önceki atasal organizma soylarında var olan biyokimyasal mekanizmalardan evrimleştiğini düşünmek için her türlü nedenimiz vardır.
– Ardea Skybreak (Evrim Bilimi – ISBN: 9789944122979)
- Schrödinger’s Mutations https://the-gist.org/2017/02/schrodingers-mutations/
- Quantum biology and Ockham's razor https://phys.org/news/2012-02-quantum-biology-ockham-razor.html
- Proton Tunnelling in DNA Mutation http://johnjoemcfadden.co.uk/popular-science/quantum-biology/mutation/
- Biology's Quantum Leap: Dissecting A Modern Hypothesis for Mutation http://large.stanford.edu/courses/2017/ph240/saffari1/
- Solving Biology's Mysteries Using Quantum Mechanics http://discovermagazine.com/2014/dec/17-this-quantum-life
- Kuantum Sınırında Yaşam - Johnjoe McFadden & Jim Al-Khalili ISBN: 9786054729791
- Quantum mechanical calculations reveal the hidden states of enzyme active sites https://chemistry.princeton.edu/news/quantum-mechanical-calculations-reveal-hidden-states-enzyme-active-sites
- Quantum Tunnnelling in Enzymes http://johnjoemcfadden.co.uk/popular-science/quantum-biology/tunnelling-in-enzymes/
Dilediğiniz miktarda aylık veya tek seferlik bağış yapabilirsiniz.
Destek OlBunlar da İlginizi Çekebilir