 Fawcett DW, The Cell: An Atlas of Fine Structure, WB Saunders, Philadelphia, 1966, p. 153.
Fawcett DW, The Cell: An Atlas of Fine Structure, WB Saunders, Philadelphia, 1966, p. 153.

1. Heterokromatin Kavramı
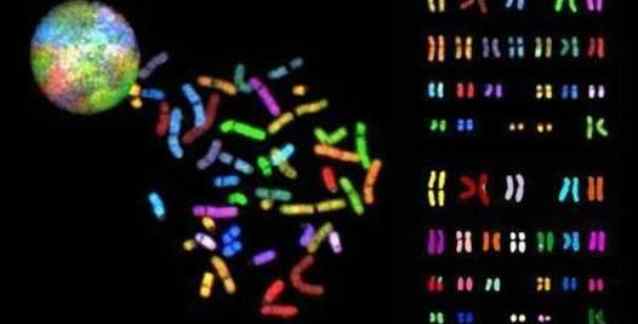
Kromatinin tanımı: Prokaryotlardan farklı olarak, ökaryotlarda DNA bir nükleoprotein kompleksi biçiminde paketlenmiştir. Kalıtımsal bilgiyi taşıyan bu nükleoprotein kompleksine “kromatin” adı verilir. Kromatin çekirdekte bulunur ve “kromozomlar” denilen birkaç ayrı parça şeklinde organize olmuş durumdadır.Heterokromatin kavramı: Emil Heitz histolojik gözlemlerine dayanarak, 1928 yılında heterokromatini (HK) interfaz çekirdeğinde aşırı yoğun ve koyu renkli görünen kromozomal bölümler olarak tanımladı. Aslında kromatin, çapları hem hücre çevrimi sırasında değişen, hem de gözlemlenen kromozom bölgesine bağlı olan iplikçiklerin düğümünü içerir. Etkin (aktif) ökromatin H2A, H2B, H3 ve H4 histonlarının homodimerlerinin (bir dimer, monomer adı verilen iki alt birimden oluşan kimyasal ya da biyolojik yapı olup, homodimer terimi iki alt ünitenin birbiriyle eş olduğunun belirtilmesi için kullanılır) etrafına sarılmış olan, çapı bir nükleozominkine (çift iplikli bir DNA bölümü) karşılık gelen bir iplikçik içerir. Durgun (inaktif) ökromatinde, bu iplikçik H1 histonları sayesinde kendini bir solenoide sarabilir. Histon-olmayan proteinlerle (topoizomeraz II, iskele protein 2, laminler…) etkileşimler yoluyla, daha ileri organize olur. Yukarıda tanımlandığı şekliyle heterokromatin söz konusu olduğunda, onu oluşturan iplikçik daha yoğunlaştırılmıştır ve çoğunlukla yığınlardan oluşuyormuş gibi görünür. Çok sayıda ilave protein içerir; bunlara HP1 (Heterokromatin Protein 1) proteinleri de dahildir.
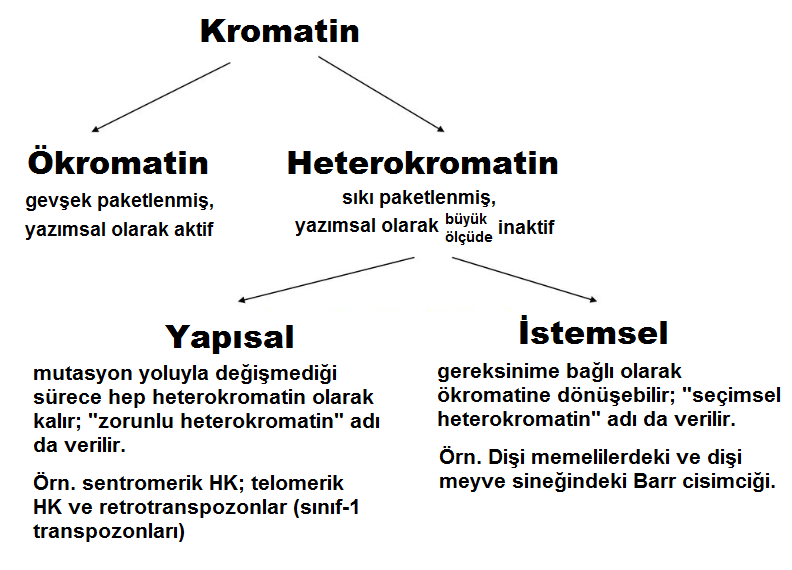
2. Heterokromatinin İki Çeşidi
İki çeşit heterokromatin bulunur: Yapısal (konstitütif) HK ve İstemsel (fakültatif) HK. Bunlar, içerdikleri DNA’ya bağlı olarak birbirlerinden hafifçe farklıdır. Uydu DNA zenginliği, heterokromatinin kalıcı olan veya olmayan yapısını, polimorfizmini ve renklenme (boyanma) özelliklerini belirler.
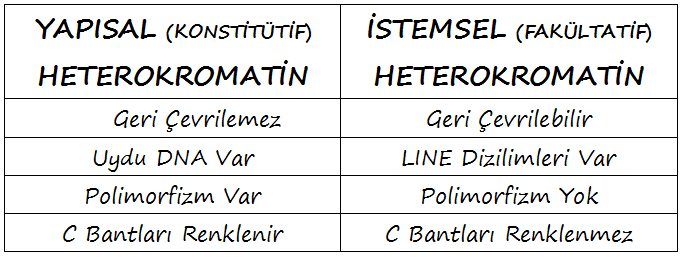
2.1 Yapısal (konstitütif) heterokromatin
- Yapısal HK, çok sayıda kısa ardışık yinelenen dizilimden oluşan uydu DNA denilen özel bir çeşit DNA içerir: Alfa-uydu DNA, DNA uydu I, II ve III. Bu uydu DNA dizilimleri, kendi üzerlerine katlanma yetisine sahiptir ve Yapısal HK’nin yüksek düzeyde yoğun, kompakt yapısının oluşumunda önemli bir rol alabilirler.
- Yapısal HK sabittir ve heterokromatik özelliklerini tüm gelişim aşamalarında ve tüm dokularda korur.
- Yapısal HK yüksek düzeyde polimorfiktir; bunun nedeni muhtemelen uydu DNA’nın durağan olmayışı (instabilliği) olabilir. Bu polimorfiklik, hem büyüklüğü hem de heterokromatinin yerelleşmesini etkileyebilir ve herhangi bir fenotipik etkisi olmadığı anlaşılmaktadır.
- Yapısal HK, C-bant tekniğiyle güçlü şekilde renklenir; bu, denaturasyonu takiben uydu DNA’nın çok hızlı yeniden-naturasyonunun sonucudur.
- İstemsel HK, LINE-tipi yinelenen dizilimlerin varlığıyla karakterize edilir. Genomun her yanına dağılmış durumdaki bu dizilimler, yoğunlaştırılmış bir kromatin yapısının yayılımını destekleyebilir.
- İstemsel HK, geri döndürülebilirdir; heterokromatik durumu, gelişim aşamasına veya incelenen hücre çeşidine bağlıdır. Dişi somatik hücrelerindeki inaktif X (Barr cisimciği) ve erkek mayozunun pakiten evresindeki inaktif cinsiyet vezikülü, İstemsel HK’ye iki örnektir.
- İstemsel HK, uydu DNA bakımından özellikle zengin değildir ve dolayısıyla polimorfik değildir.
- İstemsel HK, C-bant tekniğiyle asla renklenmez.
3. Heterokromatinin Özellikleri
Yukarıda tanımlanan farklılıklara rağmen, Yapısal (konstitütif) HK ve İstemsel (fakültatif) HK çok benzer özelliklere sahiptir.
3.1 Heterokromatin yoğundur Bu aslında heterokromatini tanımlayan şeydir ve hem Yapısal HK hem de İstemsel HK için geçerlidir. Bu yüksek yoğunlukluluk, onu kuvvetli biçimde kromofilik (renklenebilir/ boyanabilir) tutar ve DNaz-1 (deoksiribonükleaz-1) ve genel olarak diğer restriksiyon enzimlerine karşı nüfuz edilemez kılar.
3.2 Heterokromatin DNA’sı geç kopyalanır Çeşitli nükleotid türevlerinin katılımı, hem Yapısal HK’nin hem de İstemsel HK’nin DNA’larının geç kopyalandığını göstermiştir. Geç HK kopyalanması, bir yandan kopyalama mekanizmasının DNA’ya kolay erişimini engelleyen yüksek düzeyli yoğunluğunun sonucudur; diğer yandan da etkin öğelerce fakir olan çekirdeksel bölge sınırında konumlanmış olmasının sonucudur.
3.3 Heterokromatin DNA’sı metillenmiştir
- Yapısal HK’nin DNA’sı sitozinlerde yüksek düzeyde metillenmiştir. Dolayısıyla bir anti-5-metil sitozin antikor, yapısal HK’nin tüm bölgelerini kuvvetli şekilde etiketler.
- İstemsel HK söz konusu olduğunda, DNA’nın metillenmesi daha ayrıktır ama metilasyona duyarlı restriksiyon enzimleri, genlerin kontrol bölgelerinde spesifik olarak konumlanmış olan CpG adacıklarının kuvvetli metilasyonlarını açığa çıkarır.
Histonlar, kromatinin genetik etkinliğini etkileyebilen N-terminal uçlarında çevrim-sonrası (post-translasyonel) modifikasyonlar geçirebilir.
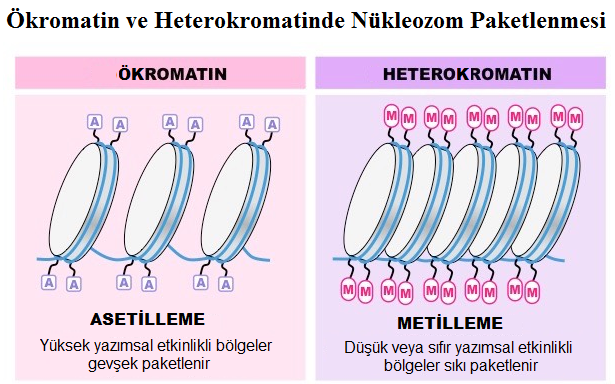
- İlkesel olarak lizinlerin üstünde bulunan histon N-terminal kuyruklarının hipo-asetilasyonu, inaktif bir kromatin ile ilişkilendirilir. Tersine, hiper-asetillenmiş histonlar aktif kromatini karakterize eder.
- Histonların asetillenmesi/de-asetillenmesi, gen ifadelenmesinin kontrolü için kesinlikle temel bir mekanizmadır. Çok sayıda yazım faktörünün ya Histon Asetil Transferaz ya da Histon De-Asetilaz etkinliğinin olduğu gösterilmiştir.
Histon H3 lizin 9 (H3-K9) metilasyonunun genomun (hem Yapısal hem de İstemsel HK’da) heterokromatinleştirilme sürecine katıldığı yeni bulunmuştur.
3.6 Heterokromatin yazımsal açıdan inaktiftir
- Meyve sineği Drosophila’dan farklı olarak, insandaki Yapısal HK herhangi bir gen içermez ve bir hücre kültürüne trityumlu üridin katmak, onun düzeyinde herhangi bir etiketlemeyle sonuçlanmaz.
- İstemsel HK gen bakımından nispeten fakirdir ve genellikle heterokromatik bir bağlamda genlerinin yazımı yapılmaz.
- Yapısal HK’nın genetik rekombinasyona katılmadığı genel kabul görmüştür. Homolog heterokromatik bölgelerin ön hazırlık çiftlenmesi olmamasının nedeni, heterokromatik bölgeleri karakterize eden polimorfizmin muhtemelen bunu zorlaştırması, hatta olanaksızlaştırmasıdır. Yapısal HK ayrıca komşu ökromatik bölgelerde rekombinasyonu baskılayıcı etki yapar.
- İstemsel HK'ye gelirsek, inaktif formunda olduğunda o mayotik rekombinasyona katılmaz.
Çeşitli organizmaların incelenmesi, interfaz sırasında Yapısal HK’nın özgün bir kümeleşme eğilimi olduğunu göstermiştir.
- Drosophila larvasında, heterokromatin bakımından zengin olan politen kromozomların sentromerleri interfaz sırasında kümeleşerek, kromosentrlar oluşturabilir.
- Farede, interfaz çekirdeklerinde gözlemlenebilen hetereokromatik blokların sayısı, metafaz kromozomlarında görselleştirilen heterokromatik bölgelerin sayısından hep daha azdır.
- İnsanda, akrosentrik kromozomların kısa kolları temelde heterokromatinden oluşmakta olup, interfaz çekirdeğinde diğer kromozomların geniş bir HK bloğuna sahip olmalarıyla (1, 9 ve 16) sıkça ilişkilendirilir. Heterokromatinin bu kümeleşme eğilimi, uydu DNA dizilimlerinin varlığına kuvvetle bağlantılı gibi görünmektedir ama ilaveten başka dizilimlerin de ilgisi olabilir.
4. Heterokromatinleşmeyle İlgili Etkenler
Bazı gözlemler, ister yapısal ister istemsel olsun, heterokromatin oluşumunda önemli rolü olan çeşitli öğelerin belirlenmesine yol açtı.
4.1 Ardışık yinelenen dizilimlerin büyük dizileri
- FISH ile görselleştirilen uydu DNA, Yapısal HK ile tam olarak kolokalize olur (aynı yerde bulunur). Dahası, uydu DNA'nın bükülme ve kendi üzerine katlanma şeklinde ayırt edici özelliği vardır ve bu, Yapısal HK'nın aşırı kompakt yapısını belirlemede önemli bir etken olabilir.
- Bununla birlikte, bu sadece uydu DNA ile ilgili değildir. Bitkilerde, Drosophila'da ve ayrıca farede bazı çok-kopyalı transgenler, sentromer baskılanmasına maruz kalmasalar bile azıcık ifadelenir veya hiç ifadelenmez.
Bu farklı gözlemler, bir DNA diziliminin çok fazla sayıda kopyasının ardışık yinelenmesinin, heterokromatin oluşumunu yönlendirmek için kendi başına yeterli olduğunu düşündürür. Böyle yinelenen dizilimler, karakteristik yapılar oluşturarak, kromatinin büyük ölçüde kompakt hâle gelmesini sağlayabilir. Bu yapılar, HP1 proteinleri gibi spesifik proteinlerce tanınabilir ve o proteinler de daha yüksek mertebeden bir kromatin oluşumunu yönlendirebilir.
4.2 DNA’nın metillenmesi Transgenlerin büyük yinelemelerinin hepsi transgenin yazımsal bir inaktivasyonuna yol açmaz. Ardışık yinelemelerle tetiklenen susturma, CpG bakımından zengin, metillenmesi muhtemel, prokaryotik DNA dizilimlerinin varlığıyla bağlantılı gibi görünmektedir. O hâlde ardışık yinelemelerin temel bileşimi, heterokromatin oluşumunda önemli bir rol oynayabilir.
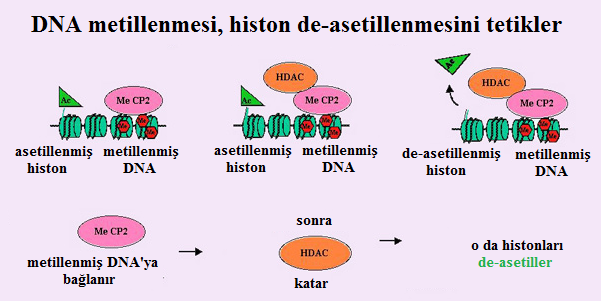
- İlginç bir şekilde, normalde DNA metillenmiş sitozinlere bağlanan metil bağlanma proteini MeCP2'nin histon de-asetilazları katabilme yetisinin olduğu gösterilmiştir (Figur 1). Dolayısıyla DNA'nın metilasyonubir histon de-asetilasyonunu tetikleyebilir ve böylece heterokromatinleşmeyi destekleyebilir.
- Bununla birlikte, DNA'nın metilasyonu heterokromatin oluşumu için vazgeçilmez değildir. Sabitleştirme ile ilgili bir öğe olabilir. Hakikaten de keselilerde inaktif X metillenmemiştir ve eteneli (plasentalı/ döleşli) memelilerden çok daha az sabittir.
4.3 Histonların hipo-asetillenmesi
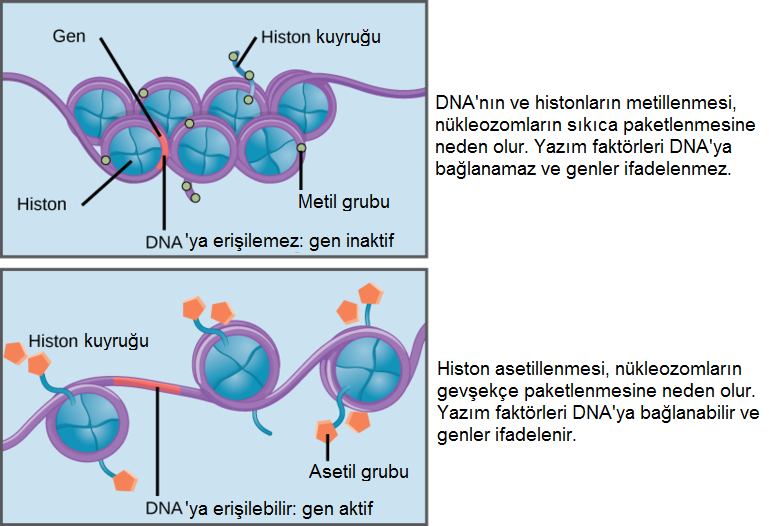
Histonların hipo-asetilasyonunun, sessiz bir kromatinin (heterokromatin olsa da olmasa da) karakteristiği olduğunu görmüştük. O nedenle, trikostatin A eklenerek histonların de-asetillenmesinin engellenmesi, histonların hiper-asetillenmesini tetikler ki o da daha açık bir kromatin yapıya neden olur.
- Aslında, lizinlerin asetilasyonu histonlardan artı yükü kaldırır ve böylece, DNA fosfatın eksi yüküyle olan çekim kuvvetini düşürerek, daha geniş açıklıklı bir kromatine yol açar.
- Tersine, lizinlerin de-asetilasyonu onların artı yükünü yeniden getiri ve böylece, DNA ile daha yakın bir çekimi destekleyerek, daha yoğun bir kromatine yol açar.
4.4 H3-K9 metilasyonu
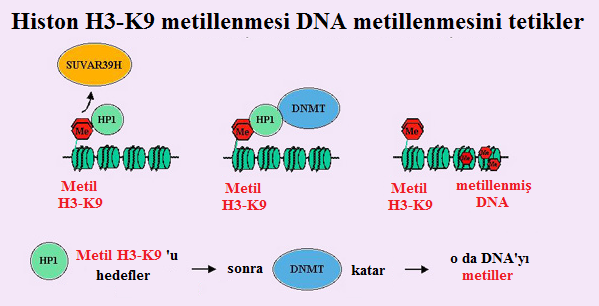
Lizin 9 üzerindeki H3 histonunun metilasyonu, hem Yapısal HK'da hem de inaktif X'te, heterokromatinleşme süreciyle ilgili olduğu yakın zamanda gösterilen bir epigenetik modifikasyondur. Bu metilasyondan sorumlu enzim histon metiltransferaz SUV39H1'dir.
- H3-K9'da, asetilasyon ve metilasyon karşılıklı olarak dışlayıcı gibi görünmektedir. Dolayısıyla Drosophila'da, metiltransferaz Suv39h, bir histon de-asetilaz ile ilişkilendirilir ve asetillenmiş bir lizin 9'un metillenmiş bir lizin 9'a doğrudan dönüşümünü sağlayan tek bir moleküler mekanizma olduğunu düşündürür.
- Buna ek olarak, H3-K9'un metilasyonu, heterokromatin protein HP1 için yüksek-duyarlıklı bir bağlanma bölgesi yaratır. Suvar39h'nin HP1 ile birlikte- immunopresipitasyonu, bu iki protein ile lizin 9'un etkileşimine dayalı bir heterokromatinleşme mekanizmasını akla getirir.
- Son olarak, Neurospora crassa'da, H3-K9'un metilasyonunun DNA'nın metilasyonuna neden olabileceği yakın zamanda gösterilmiştir (Figur 2).
4.5 HP1 proteinleri
Heterokromatin organizasyonunda HP1 proteinlerinin özgün bir rolü var gibi görünmektedir. Drosophila'da konum etkisi ile çeşitlenme incelemeleri (İng. variegation by position effect- PEV etkisi) ve Drosophila ile farede transgen incelemeleri, bu proteinlerin rolünün daha iyi bir kavrayışına olanak tanımıştır.
- Drosophila'da, HP1 proteini Su(var)205 geni tarafından kodlanır; bu gen, PEV etkisini modifiye edebilen çeşitlenmenin baskılayıcısıdır. Konum etkisiyle çeşitlenme şöyle tanımlanabilir: Normalde aktif ökromatinde yerelleşen genler, kromozomun yeni baştan düzenlenişini takiben heterokromatik oln bir sentromerik bölgeye yerleşebilir. Ardından, henüz konum değişikliği geçiren kromatin çok daha kompakt duruma gelir ve normalde sentromerlerde kısılı kalmış olan HP1 proteinleriyle ilişki kurabilir. Dahası, konum değişimi geçiren kromatinde bulunan genler baskılanmış hâle gelir.
- Farede, bir transgeni sentromere yakın yerleştirmek benzer sonuçlar doğurabilir. Sentromerik bir etkinin sonucu olarak değil de, çok sayıda kopyasının varolmasının sonucu olarak bir transgenin baskılandığı yerde bile, HP1 proteinlerinin de baskılanmış kromatinle ilişkili olduğunun bulunmasını fark etmek ilginçtir. Heterokromatin oluşumunda HP1 proteinleri elzem bir bağlantı gibi görünmektedir ve kromatin alan düzenleyicileri rolleri olabilir. Bu proteinler, yinelemeli DNA dizilimlerinin ilişkilenmesi ve/veya çiftlenmesi ile yaratılan özgün yapıları tanıyabiliyor gibi görünmektedir. Ek olarak, kromo-alan (İng. chromodomain - CD) ve kromo-gölge alan (İng. chromoshadow domain - CSD) sayesinde, çok sayıda başka proteinle ikincil etkileşimler kurma yetileri vardır.
- Bazı çekirdeksel RNA'ların İstemsel HK oluşumuna katkıda bulunabildiği hâlihazırda açıkça ortaya konmuştur. Dişi memelilerin somatik hücrelerindeki bir X kromozomunun istemsel inaktivasyonunun başlatılışında XIST geninin yazımlarının temel bir rolü vardır.
- Farelerde yeni yapılan bazı çalışmalar, çekirdeksel yazımların Yapısal HK oluşumuyla da ilgisinin olabileceğini düşündürmektedir. Fare hücrelerinde sentromerik HK, metillenmiş H3-K9 histonunun ve heterokromatik HP1 proteinlerinin yüksek yoğunluğuyla karakterize edilir; bunlar inkübasyondan sonra RNaz A ile hızla delokalize olur. Bu durum, bir çekirdeksel RNA'nın, Yapısal HK'nin temel bir bünyesel bileşeni olabileceğini akla getirir.
5. Heterokromatinin İşlevleri
Sık polimorfizlerinin herhangi bir işlevsel veya fenotipik etkisi yomuş gibi göründüğünden, insan genomunda heterokromatinin net rolü uzun süre boyunca gizemini korudu.5.1 Çekirdeksel bölgelerin organizasyonunda HK’nin rolü
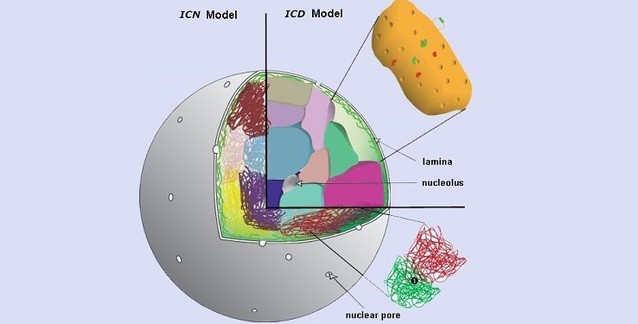
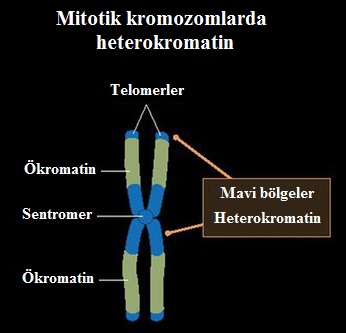
- Heterokromatin ve ökromatin farklı çekirdeksel bölgeleri işgal eder. HK genellikle çekirdeğin sınırında yerelleşir ve çekirdeksel zara tutunur. Tersine, aktif kromatin daha merkezi bir konumu işgal eder.
- HK'nın tercihan çekirdeksel zarın karşısında yerelleşmesi, HP1 proteininin lamin B almacıyla (çekirdeğin iç zarının tümleşik bir bileşenidir) etkileşimine bağlı olabilir.
- HK'nın sınırda yerelleşmesi, aktif öğeleri çekirdeğin merkezine doğru yoğunlaştırarak, aktif ökromatinin kopyalanmasını ve en yüksek verimle yazımının yapılmasını sağlar.
- Schizosaccharomyces pombe mayasında, HP1 proteininin homologu olan Swi6, hücre bölünmesi sırasında kardeş kromatitlerin verimli bitişikleşmesi için kesinlikle gereklidir.
- Dahası, uydu DNA silinmesini içeren deneyler, sentromerin doğru işleyişi için uydu DNA yinelemelerininin büyük bir bölgesinin vazgeçilmez olduğunu göstermiştir. Sentromerik HK'nın, de facto, sentromerik histon varyantı CENP-A'nın yerel yoğunluğunu artırarak ve kopyalanma sırasında histon H3 yerine CENP-A'nın katılımını destekleyerek, bir bölme oluşturabileceği varsayılmaktadır.
Gen ifadelenmesi iki düzeyde kontrol edilebilir:
- Birincisi yerel düzeyde olan yazım kontrolü olup, yerel yazım kompleksleri sayesinde gerçekleştirilir. Bu düzey, tekil genlerle bağlantılandırılan nispeten küçük DNA dizilimleriyle ilgilidir.
- Daha global bir düzeyde ise yazımın yapılabilirliği kontrol edilir. Bu, daha büyük bir kromatin (aktif veya inaktif durumda olabilir) bölgesini temsil eden daha büyük dizilimlerle ilgilidir. Heterokromatin, genomun yazımının yapılabilirliğinin kontrolü ile ilgili gibi görünmektedir. Genellikle ökromatinde konumlanan genler, dolayısıyla, bir heterokromatik bölgeye yakın yerleştirildiklerinde susturulabilirler.
trans’ta inaktivasyon mekanizması: Hücre farklılaşması sırasında, bazı aktif genlerin bir heterokromatik çekirdeksel bölgeye kayması muhtemeldir; bu da onların inaktif hâle gelmesine neden olur. Böyle bir mekanizma, IKAROS proteininin lenfosit çekirdeklerinin kolokalize olması ve onun ifadelerini kontrol ettiği sentromerik heterokromatinli genler için bir açıklama olarak ileri sürülmüştür.
6. Heterokromatin Hastalıkları
6.1 Yapısal heterokromatin hastalıklarıBu hastalıklar genellikle hücre farklılaşması sürecindeki değişikliklerin sonucudur.
- Yapısal olabilirler: ICF sendromu veya Robert sendromundaki gibi. ICF sendromu bağışıklık yetersizliği (İng. Immunodeficiency), sentromerik kararsızlık (İng. Centromeric instability) ve yüz anomalileri (İng. Facial anomalies) ile ilişkilendirilir. Ender rastlanan çekinik bir hastalık olup, bir DNA metil transferaz olan DNMT3B genindeki mutasyonlarla bağlantılandırılır. G-C zengini uydu DNA’lar II ve III özellikle demetillenmiştir ki bu kardeş kromatitlerin anormal ayrışmasına, multiradyal figürlerin oluşumuna, silinmelere, mikro-çekirdeklere vb. neden olabilir.
- Edinilmiş olabilirler: Çok sayıda kanser çeşidinde, DNA veya heterokromatin proteinleri ile ilgili yapısal heterokromatin anomalileri bulunmuştur. -- Özellikle belirtecek olursak, Non-Hodgkin Lenfoması ve çoklu miyelomanın, kromozom 1’in ikincil daralmasının anomalileriyle ilişkili olduğu gösterilmiştir; bu anomaliler ICF sendromunda gözlemlenenlere benzerdir. Gerçekten de, özellikle DNA uydusu II’nin hipometilasyonu ile ilişkilendirilen bir global genom hipometilasyonu olduğu gösterilmiştir. -- Metastatik göğüs kanserinde, genellikle kromozomların heterokromatik bölgelerinde yerelleşen bir protein olan HP1 alfa proteininde bir artış olduğu gösterilmiştir.
- Dişi somatik hücrelerindeki bir X kromozomunun inaktivasyonundaki bir hatadan kaynaklanabilirler (XIST geninde mutasyon) ve dişilerde X-bağlantılı çekinik bir hastalığın ifadelenmesine yol açabilirler.
- Erkek germ hücrelerindeki cinsiyet vezikülünün yoğunlaştırılmasındaki bir hatadan kaynaklanarak, mayozun pakiten kilitlenmeye bağlı olarak kısırlığa yol açabilirler.
7. Sonuç
Sonuç olarak, her ne kadar heterokromatin görünüşte amorf ve çekirdek sınırında yalıtılmış olsa da, genomun düzenlenişinde ve işleyişinde kesinlikle temel bir rol oynuyor gibi görünmektedir. Bu incelemede biz, ister yapısal ister istemsel olsun, heterokromatin ile bağlantılı özellikleri ele aldık.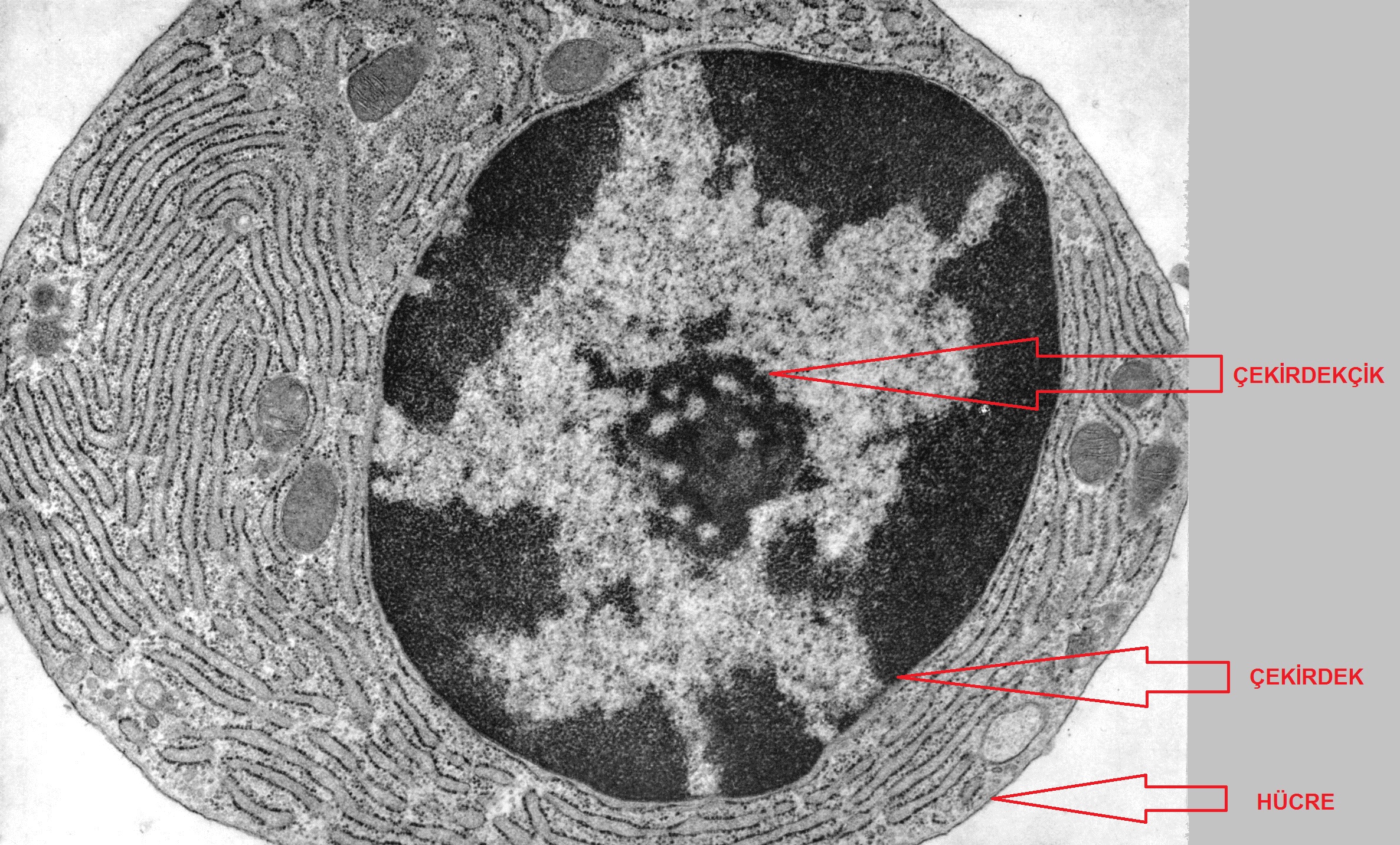
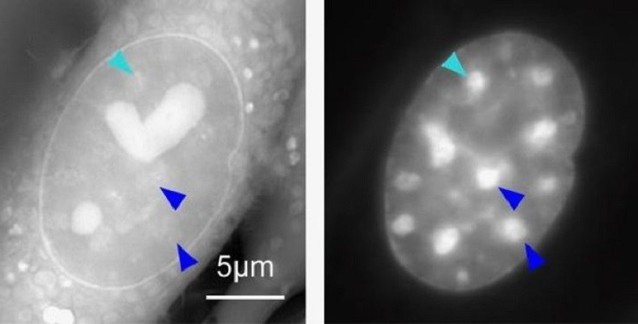
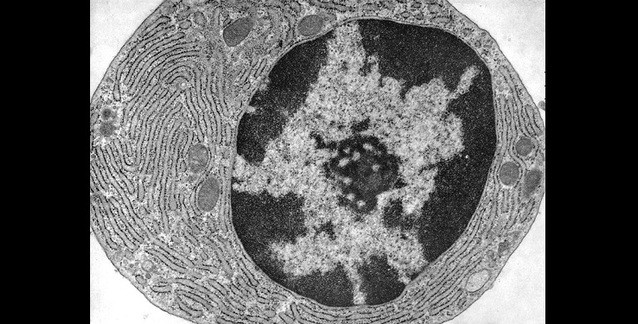
Çekirdekçiğin hemen dışında açık renkli ökromatin ve daha dışta çekirdek çeperlerine
doğru koyu renkli heterokromatin görülebilir.
(Kaynak: Fawcett DW)
- Marie-Geneviève Mattei, Judith Luciani © Atlas of Genetics and Cytogenetics in Oncology and Haematology http://atlasgeneticsoncology.org/Educ/HeterochromEng.html
- Hücre mikrografı http://www.columbia.edu/itc/hs/medical/sbpm_histology_old/lab/lab01_micrograph.html
- Histon tanımı görseli http://e-wiki.org/tr/images/Histone_definition
- Nükleozom paketlenmesi görseli https://ib.bioninja.com.au/higher-level/topic-7-nucleic-acids/72-transcription-and-gene/epigenetics.html
Dilediğiniz miktarda aylık veya tek seferlik bağış yapabilirsiniz.
Destek OlBunlar da İlginizi Çekebilir