 Jenna Hambrick, La Jolla Institute for Immunology
Jenna Hambrick, La Jolla Institute for Immunology
Yıldız Teknik Üniversitesi - Çevirmen/Editör

DNA alfabesindeki dört asıl baza (Adenin, Sitozin, Guanin, Timin) ek olarak, "beşinci" bir bazın daha olduğu söylenebilir: 5-metilsitozin (5mC). Bu baz, genlerin ve diğer DNA öğelerinin açılıp kapanması kararında son derece önemli bir rol oynar. Bekleneceği üzere, sitozin metillenmesindeki kusurlar gelişimsel anormalliklerle, genetik hastalıklarla ve kanserle ilişkilendirilir.
La Jolla Bağışıklık Bilimi Enstitüsü araştırmacıları, bir süre önce yaptıkları bir çalışmada, DNA metilasyonu ile demetilasyonu arasındaki ince ayarlı dengenin, genomik istikrarsızlığı ve kanseri nasıl engellediğini açığa çıkardı. İlgili makale PNAS dergisinde yayımlandı.
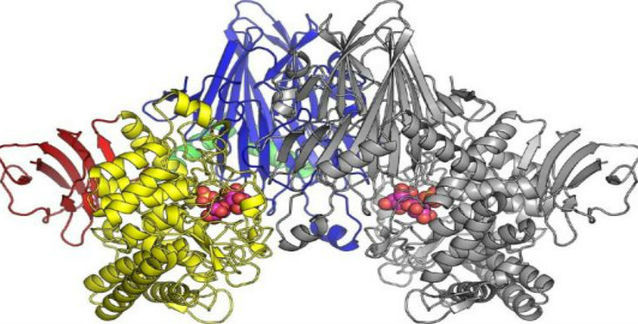
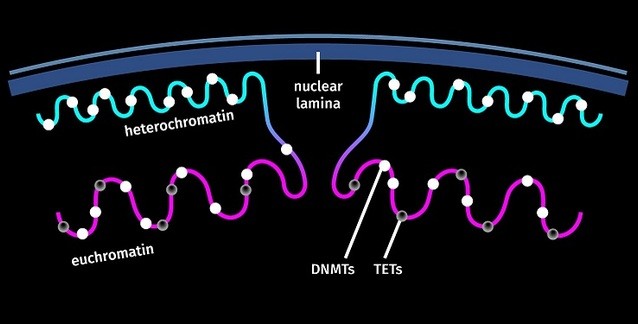
Bilimciler, DNMT'ler olarak bilinen enzimlerin, sitozinlerin üzerine 5mC işaretinin koyulmasından sorumlu olduklarını biliyordu ancak bu işaretin nasıl kaldırıldığı onlarca yıldan bu yana gizemini korumaktaydı. Daha önce yapılan bir çalışmada, yeni çalışmanın kıdemli yazarı Anjana Rao ve eski çalışma arkadaşları, TET'ler olarak bilinen kanserle ilişkili proteinlerin 5mC bazını "altıncı" bir baza, yani 5hmC'ye çevirdiğini ortaya koymuştu; o da daha sonra C'ye dönüşüyordu. Kısa süre sonra, TET işlevinin yitiminin, hem farelerde hem de insanlarda pek çok kanser tipi ile bağlantılı olduğu açıklık kazandı.
Her ne kadar DNMT'ler ile TET'lerin karşıt etkinliklerinin olması beklense de (DNMT'ler 5mC üretirken, TET kaldırır), TET2 veya DNMT3A'da mutasyon bulunan insan kan kanserleri benzer özellikler sergiler; bunlara artan DNA hasar düzeyi ve genom istikrarsızlık düzeyi dahildir. Dahası, DNMT3A ve TET2, klonal hematopoezde (kan kök hücrelerinin belirli klonlarının diğerlerin daha fazla genişlediği bir yaşlanma hastalığı) mutasyon geçiren en baş iki proteindir. Bu hastalıktan muzdarip olan kişiler, damar sertleşimi ve ilerleyen kanser riski altındadır.
Rao ve ekibinin son bulguları, TET'lerdeki ve DNMT'lerdeki mutasyonların hastalıkta niçin benzer etkileri olduğuna ilişkin bir açıklama sunuyor. Çalışmanın başyazarı olan lisansüstü öğrencisi Isaac F. López-Moyado, fare T-hücrelerinde TET2 ve TET3 silindiğinde oluşan bir agresif lenfomadaki metilasyon şablonlarını analiz ettiğinde, beklendiği gibi genomun geniş bölgelerinde DNA metilasyonunun arttığını buldu. Ancak aynı kanser örnekleri, kanserleşmemiş normal T-hücrelerine kıyasla, DNA metilasyonunu yitirmiş olan eşit ölçüde geniş genomik bölgelere sahipti.
López-Moyado, bunun şaşırtıcı olduğunu çünkü son on yıldır, TET mutasyonlarının artmış DNA metilasyonuna yol açtığının kabul edildiğini belirtiyor. Bu, bazı genomik bölgeler için doğruyken, heterokromatin olarak bilinen büyük genom kısımları için doğru değil. Heterokromatin, sıkıca paketlenmiş ve genellikle inaktif olan, tipik olarak çekirdeğin çeperlerine doğru yerleşen bir DNA biçimidir. TET kusuru olan hücrlerde Dnmt3a moleküllerinin dağılımına daha yakından bir bakış, Dnmt3a moleküllerinin bir kısmının heterokromatinden uzağa taşındığını gösterdi; bu da, genomun bu bölgesindeki görünüşte paradoksal olan metilasyon kaybını açıklıyordu.
İlginç bir şekilde, azımsanamayacak miktardaki lösemi hastası, hem TET2 hem de DNMT3A mutasyonlarını taşır ve hem TET2'de hem de DNMT3A'da ikili mutasyon taşıyan farelerin, sadece TET2 veya sadece DNMT3A mutasyonu taşıyanlardan daha şiddetli kanserler geliştirdikleri bilinmektedir. Bu gözlem, çifte mutasyonun heterokromatinin metilasyon durumundaki değişikliklerle bağlaşık olup olmadığını ortaya koymak için López-Moyado'yu fare hematopoetik kök hücrelerinden (kan kanserlerinin doğduğu hücreler) çıkan yayımlanmış verileri analiz etmeye itti.
Araştırmacı, bu iki mutasyondan sadece birine sahip hücrelere kıyasla, TET2 ve DNMT3A mutasyonlarının her ikisine de sahip olan hücrelerin heterokromatinde daha fazla DNA metilasyon yitimi sergilediğini buldu. Aslında, TET veya DNMT3A'da mutasyon olmasa bile, kanser durumunda heterokromatinde azalmış DNA metilasyonu yaygındır; bu da TET ve DNMT işlevlerinin yitiminin işin içinde olabileceğini akla getirir.
Heterokromatin, memeli genomlarının yarısından fazlasını oluşturur. Herhangi belli bir hücre tipinde susturulması gereken genlerin yanı sıra, genomu uzun süre önce işgal etmiş olan "asalak" DNA öğeleri ve çeşitli "yinelenen" dizilimler içerir. Aralarında transpozonların ve antik virüslerin olduğu bu DNA öğeleri, heterokromatinde kesin olarak baskılanmalıdır. Eğer heterokromatin DNA metillenmesi yitirirse, bu öğeler yeniden aktifleşebilir ve normal dışı yapılar oluşturabilir veya bir genomik konumdan başka yere sıçrayarak, genomik istikrarsızlığa ve DNA hasarına yol açabilir; bunlar da kanser işaretidir. Gerçekten de bu özellikler, kalıtımsal olmayan kanserler kadar, kalıtımsal olanların da çoğu tipinde (TET ve DNMT3A mutasyonlular da dahil olmak üzere) DNA hipometilasyonu eşliğinde sıkça gözlemlenir.
İleride yapılacak araştırmalar, DNA metilasyon yolağındaki mutasyonlardan dolayı heterokromatinde oluşan DNA metilasyonu yitiminin, heterokromatinin yeniden aktifleşmesinde, kanser başlamasında ve ilerlemesinde doğrudan bir rolü olup olmadığını ortaya koyacaktır.
La Jolla Bağışıklık Bilimi Enstitüsü araştırmacıları, bir süre önce yaptıkları bir çalışmada, DNA metilasyonu ile demetilasyonu arasındaki ince ayarlı dengenin, genomik istikrarsızlığı ve kanseri nasıl engellediğini açığa çıkardı. İlgili makale PNAS dergisinde yayımlandı.
Bilimciler, DNMT'ler olarak bilinen enzimlerin, sitozinlerin üzerine 5mC işaretinin koyulmasından sorumlu olduklarını biliyordu ancak bu işaretin nasıl kaldırıldığı onlarca yıldan bu yana gizemini korumaktaydı. Daha önce yapılan bir çalışmada, yeni çalışmanın kıdemli yazarı Anjana Rao ve eski çalışma arkadaşları, TET'ler olarak bilinen kanserle ilişkili proteinlerin 5mC bazını "altıncı" bir baza, yani 5hmC'ye çevirdiğini ortaya koymuştu; o da daha sonra C'ye dönüşüyordu. Kısa süre sonra, TET işlevinin yitiminin, hem farelerde hem de insanlarda pek çok kanser tipi ile bağlantılı olduğu açıklık kazandı.
Her ne kadar DNMT'ler ile TET'lerin karşıt etkinliklerinin olması beklense de (DNMT'ler 5mC üretirken, TET kaldırır), TET2 veya DNMT3A'da mutasyon bulunan insan kan kanserleri benzer özellikler sergiler; bunlara artan DNA hasar düzeyi ve genom istikrarsızlık düzeyi dahildir. Dahası, DNMT3A ve TET2, klonal hematopoezde (kan kök hücrelerinin belirli klonlarının diğerlerin daha fazla genişlediği bir yaşlanma hastalığı) mutasyon geçiren en baş iki proteindir. Bu hastalıktan muzdarip olan kişiler, damar sertleşimi ve ilerleyen kanser riski altındadır.
Rao ve ekibinin son bulguları, TET'lerdeki ve DNMT'lerdeki mutasyonların hastalıkta niçin benzer etkileri olduğuna ilişkin bir açıklama sunuyor. Çalışmanın başyazarı olan lisansüstü öğrencisi Isaac F. López-Moyado, fare T-hücrelerinde TET2 ve TET3 silindiğinde oluşan bir agresif lenfomadaki metilasyon şablonlarını analiz ettiğinde, beklendiği gibi genomun geniş bölgelerinde DNA metilasyonunun arttığını buldu. Ancak aynı kanser örnekleri, kanserleşmemiş normal T-hücrelerine kıyasla, DNA metilasyonunu yitirmiş olan eşit ölçüde geniş genomik bölgelere sahipti.
López-Moyado, bunun şaşırtıcı olduğunu çünkü son on yıldır, TET mutasyonlarının artmış DNA metilasyonuna yol açtığının kabul edildiğini belirtiyor. Bu, bazı genomik bölgeler için doğruyken, heterokromatin olarak bilinen büyük genom kısımları için doğru değil. Heterokromatin, sıkıca paketlenmiş ve genellikle inaktif olan, tipik olarak çekirdeğin çeperlerine doğru yerleşen bir DNA biçimidir. TET kusuru olan hücrlerde Dnmt3a moleküllerinin dağılımına daha yakından bir bakış, Dnmt3a moleküllerinin bir kısmının heterokromatinden uzağa taşındığını gösterdi; bu da, genomun bu bölgesindeki görünüşte paradoksal olan metilasyon kaybını açıklıyordu.
İlginç bir şekilde, azımsanamayacak miktardaki lösemi hastası, hem TET2 hem de DNMT3A mutasyonlarını taşır ve hem TET2'de hem de DNMT3A'da ikili mutasyon taşıyan farelerin, sadece TET2 veya sadece DNMT3A mutasyonu taşıyanlardan daha şiddetli kanserler geliştirdikleri bilinmektedir. Bu gözlem, çifte mutasyonun heterokromatinin metilasyon durumundaki değişikliklerle bağlaşık olup olmadığını ortaya koymak için López-Moyado'yu fare hematopoetik kök hücrelerinden (kan kanserlerinin doğduğu hücreler) çıkan yayımlanmış verileri analiz etmeye itti.
Araştırmacı, bu iki mutasyondan sadece birine sahip hücrelere kıyasla, TET2 ve DNMT3A mutasyonlarının her ikisine de sahip olan hücrelerin heterokromatinde daha fazla DNA metilasyon yitimi sergilediğini buldu. Aslında, TET veya DNMT3A'da mutasyon olmasa bile, kanser durumunda heterokromatinde azalmış DNA metilasyonu yaygındır; bu da TET ve DNMT işlevlerinin yitiminin işin içinde olabileceğini akla getirir.
Heterokromatin, memeli genomlarının yarısından fazlasını oluşturur. Herhangi belli bir hücre tipinde susturulması gereken genlerin yanı sıra, genomu uzun süre önce işgal etmiş olan "asalak" DNA öğeleri ve çeşitli "yinelenen" dizilimler içerir. Aralarında transpozonların ve antik virüslerin olduğu bu DNA öğeleri, heterokromatinde kesin olarak baskılanmalıdır. Eğer heterokromatin DNA metillenmesi yitirirse, bu öğeler yeniden aktifleşebilir ve normal dışı yapılar oluşturabilir veya bir genomik konumdan başka yere sıçrayarak, genomik istikrarsızlığa ve DNA hasarına yol açabilir; bunlar da kanser işaretidir. Gerçekten de bu özellikler, kalıtımsal olmayan kanserler kadar, kalıtımsal olanların da çoğu tipinde (TET ve DNMT3A mutasyonlular da dahil olmak üzere) DNA hipometilasyonu eşliğinde sıkça gözlemlenir.
İleride yapılacak araştırmalar, DNA metilasyon yolağındaki mutasyonlardan dolayı heterokromatinde oluşan DNA metilasyonu yitiminin, heterokromatinin yeniden aktifleşmesinde, kanser başlamasında ve ilerlemesinde doğrudan bir rolü olup olmadığını ortaya koyacaktır.
Kaynak ve İleri Okuma
- TET proteins: double agents in DNA methylation prevent catastrophic cancer https://medicalxpress.com/news/2019-07-tet-proteins-agents-dna-methylation.html
- Isaac F. López-Moyado el al., "Paradoxical association of TET loss of function with genome-wide DNA hypomethylation," PNAS (2019). www.pnas.org/cgi/doi/10.1073/pnas.1903059116" www.pnas.org/cgi/doi/10.1073/pnas.1903059116
Etiket
Projelerimizde bize destek olmak ister misiniz?
Dilediğiniz miktarda aylık veya tek seferlik bağış yapabilirsiniz.
Destek Ol
Yorum Yap (0)
Bunlar da İlginizi Çekebilir
11 Eylül 2015
Sibirya'da Keşfedilen Donmuş Virüs Uyandırılıyor