Gama-Aminobütrik asit (GABA), beyindeki başlıca baskılayıcı (inhibitör) nöro-ileticidir (İng. neurotransmitter). Tüm kontrol düğmelerini kontrol eden düğme odur. Peki ama neden GABA? Bu molekülü bu kadar özel yapan şey ne olabilir?
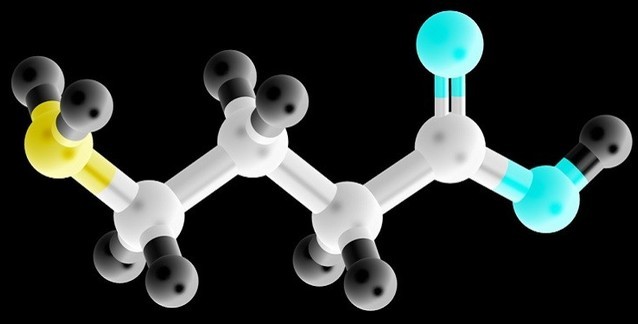
Baktığınız zaman, GABA'nın dört-karbonlu minik omurga yapısının kendisinde garip olan hiçbir şey yoktur. Çözelti içindeki çözünüm etkileri, GABA'nın beş farklı olası düzenlemeye sahip olabilmesine olanak tanır; bazıları daha kompakt iken, bazıları daha yayvandır. Almaç düzeyinde bu esnekliğin anlamı, GABA'nın yüksek ölçüde ilaçlara bağlanabilir bir hedef olduğudur. Başka bir deyişle, GABA'nın ilaç şeklindeki benzerleri, seçilmiş almaç altkümelerinde daha sıkı paketlenebilirdir ve dolayısıyla potansiyel olarak son derece spesifiktir.
Eğer GABA'nın kendisi tümüyle sıradan ise belki de şans eseri metabolizmanın değerli bir bölgesinde mi bulunuyor acaba? Metabolik çevrimlerin zirvedeki konumlarından bazıları Asetil-CoA ve ATP gibi moleküller tarafından işgal edilmiştir. Asetil-CoA molekülü, glikoliz, TCA çevrimi, keton üretimi, lipidlerin β-oksidasyonu ve yağlı asit uzatılmasının tam kesişiminde yer alır. Hatta asetilkolin nöro-ileticisinin sentezine de doğrudan katılır. İlginç bir şekilde, bu karmaşık molekül ile ilişkilendirilen herhangi bir başlıca almaç sistemi yoktur.
ATP, Asetil-CoA molekülünden daha dar bir ayak izine sahiptir ama kesinlikle becerisinde bir gerilik yoktur. Oksidatif fosforilasyon ile nükleotit metabolizmasını doğrudan bağlantılandırır ve kendi özel zar almaçları kümesi tarafından kontrol edilir. Tıpkı GABA ekosistemi gibi, ATP de beklenen tüm iyonotropik ve metabotropik almaç işlevlerini içeren eksiksiz hizmet takımıyla gelir. GABA söz konusu olduğunda, bu almaç etkileri geleneksel olarak GABAA ve GABAB almaçları olarak düzgünce gruplanır. GABAA almaçları klorid iyonları için kanal görevi görürken, GABAB almaçları da G-protein bağının altına sinyalleme yapar.
K Kanalları
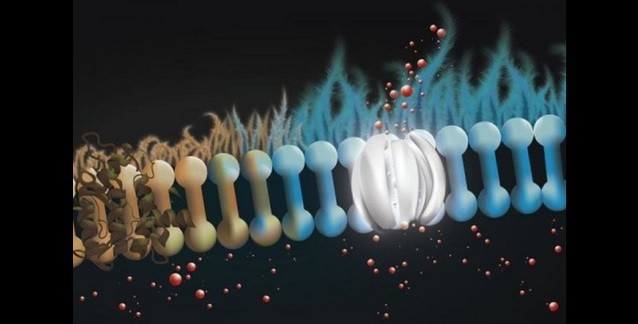
Bu düzenli resim bir süre önce sarsıntıya uğradı. Haberler, GABA'nın doğrudan potasyum (K) kanalları açtığı yönündeydi. K kanalları gerilime yanıt verir ve normalde bir nöronu hiperpolarize eder veya ani bir gerilim yükselmesinden sonra yeniden kutuplar. Geçtiğimiz günlerde Nature dergisinde yayımlanan bir makalenin yazarları, KCNQ almaç ailesinin evrimsel olarak korunmuş olan sadece GABA'ya ayrılmış bir noktalarının olduğunu buldu.
KCNQ kanalları, agonist muskarin tarafından tetiklenebilen 'M' akımını taşır. Bu almaç-benzeri eylem, inaktivasyon yokluğu ve operasyonun gerilim aralığı nedeniyle, bu M kanallarının nöronal uyarılganlığın düzenleyicileri olduğu söylenir. Sıklıkla, bunun anlamı, bir nöronun ateşleme örüntüsünü fazikten toniğe çevirdikleridir. Bazı durumlarda, güçlü M akımları olan nöronlar, gerilim kontrollü salınıcı olarak idealize edilebilir. Böyle bir cihaz, girdi olarak bir analog gerilim alıp, değişken frekanslı çıktı üretir. Cihazın bir varyasyonu, atım-kodlu modülasyon, sıkıştırılmamış sesler için kullanılan genel kodlama yöntemidir.
K iyon kanal duyarlılığının yeni keşfedilen bu becerisinin, elektrofizyoloji dünyası için büyük önem taşıdığına kuşku yok. Yine de riske girip, GABA'nın gizinin muhtemelen beynimizde dijital ses oluşturmak olmadığı ileri sürülebilir. Belki de o boşluktaki diğer tür almaçların, yavaş ve tombul GABAB metabotropik almaçların neler yapıyor olabileceğine daha yakından bakmalıyız. Bu amaçla, GABA baloncuğunun dışına çıkıp, herhangi bir G-protein çiftlenimli almacın hücre için aslında ne yaptığını sormalıyız.
Bu almaçların hepsinin, GTP nükleotit hidrolizinin bazı dışsal kontrollerini değişmez şekilde sağlaması bir ipucu olabilir. Bu kapsamda, ayrıca GTP ve GDP durumunun "dürüst sinyalciler"i olarak da iş görür. Bundan başka, G protein alfa altbiriminin kendisinin uyarıcı ya da baskılayıcı olmasına bağlı olarak, sıradaki ikinci haberci de (bu durumda adenilat veya guanilat siklaz) nükleotitlerle ilgilenir. Yani, her biri kendi adaşı olan trinükleotitten bir fosfat ikilisi ayırır ve sonra kalan molekülü bir düğüme kitler; ta ki fosfodiesterazlar nihayetinde ayırana dek.
Nükleotitler Kimin İlgisini Çeker?
Hücrede kim nükleotitlere ilgi duyabilir? Nöronlar genellikle kendi hücre çevrimlerinin G0 yaşlılık evresine kısılıp kalır ve bir sonraki hücre bölünmesi için yeterince nükleotite sahip olma konusunda endişelenmez. Beklenen bir şey yoktur. Çekirdeklerinin sadece ufak ama durağan bir deoksinükleotit rezervine gereksinimi vardır; o da DNA onarım gerekliliklerini yerine getirmek içindir. İnsanlarda bu, çekirdek başına günde 10.000 oksidatif lezyon civarında olur. O nedenle, nöronlar yeni nükleotit sentezi enzimlerini azaltarak düzenlemekte özgürdür.
Öte yandan mitokondriler, nükleotitler ile aşırı derecede ilgilenir. Ellerinde çeşitli nükleotit kurtarma ve onarma yöntemi olmakla beraber, talep yüksektir. Mitokondriyal DNA sürekli olarak mutasyonlara ve kısmi silinmelere maruz kalır; mitokondriler kendilerini ve nükleotitlerini kopyalarken aralıksız olarak yenilenmesi gerekir.
Peki GABA sinyallemesi ve metabolizmasının nükleotit durumu ile doğrudan ilgili olduğuna ilişkin herhangi bir kanıt var mı? GABA döngüsü (İng. GABA shunt), sinir sisteminde dikkat çekici biçimde yer alan TCA çevrimi (trikarboksilik asit çevrimi, sitrik asit çevrimi ve Krebs çevrimi adlarıyla da bilinir) üzerindeki bir tali yoldur. Özellikle beyin kabuğu (korteks), aslında kocaman bir GABA yoludur. Beyin kabuğunun ayrıntılı moleküler yapısı, metabolizmanın bu belirli bölgesini büyüttüğünüzde ortaya çıkar ve çevresine daha yüksek bir beyin lobunun bütününü inşa eder. Yani bizim en incelikli nöral donanımımız, ince işlenmiş üç parçalı bir sinaptik donanım üzerinde, nispeten basit bir GABA-glutamat-glutamin metabolik çevrimi işletir. Bu, aracı nöron, piramitsel hücre ve astrosit tarafından optimize edilen, aralıksız çalkalanan zarsı bir sınır boyunca birbirleri ile karşılıklı iletişim içindeki üç farklı tür mitokondrinin işbirliğidir.
GABA döngüsünün kalkış noktası, TCA çevrimindeki alfa-ketoglutaratta yatar ve yeniden giriş noktası suksinata bağlar. Başlıca dallanma noktalarından biri olan suksinat, her şeyde rolü olan bir diğer zirve molekülüdür. Asetil-CoA gibi o da tüm büyük enerji yolları ile bağlantılıdır ve hatta kolesterol ve hem (İng. heme) gibi özel siparişlere de katkıda bulunur. Benzer biçimde, suksinatın da bir asetilli versiyonu vardır ve TCA çevriminde suksinat ile alfa-KG arasında bulunur.
(Telif: studyblue.com)
Buradaki anahtar gözlem şudur: Onu suksinata çeviren enzim suksinil-CoA ligaz (diğer adıyla suksinil-CoA sintaz) çok önemli bir özelliğe sahiptir. Çevrimin ileri yönünde işlediği zaman, pürin nükleotitleri de üretir. Bedendeki farklı dokular, değişik ikincil altbirimler kullanarak, bu enzimin biraz farklı versiyonlarını üretir. SUCLG2 versiyonu, karaciğer ve böbrekler gibi anabolik dokuda GTP yaparken, SULCA2 versiyonu beyin ve kas gibi katabolik doku için ATP yapar. Bu altbirimlerden herhangi biri mutasyona uğradığında, mitokondriyal bozukluklarla karşılaşılır. Net semptomlar, hangi dokuda hangi varyantların olduğuna bağlıdır.
Tüm tıp tarihindeki en kafa karıştırıcı zihinsel görüngülerden bazılarının, nükleotit metabolizmasında gereken enzimlerdeki genetik defolar nedeniyle olduğunu da söylemek gerek. Lesch-Nyhan sendromu ve katı insan sendromu ile bağlantılı olduğu bilinen pürin-kurtarma yollarının tuhaf semptomolojisi gibi.
TCA'daki suksinatın diğer ucunda fumarat bulunur. Fumarat, metabolik talep fazla olduğunda etkin dokuda çalışmaya başlayan bir rezerv pürin çevrimi yoluyla da çevrime girebilir. TCA çevriminin normal işleyişi, içsel mitokondriyal zarda suksinat dehidrojenaz yoluyla suksinattan fumarat üretir. Bu enzim, solunumsal zincir elektron taşınımında Kompleks II ile eşzamanlı olarak işler.
Yukarıdaki diyagramdan, GABA döngüsünün, suksinil-CoA sentazın bu kritik nükleotit üretim adımını atlıyor gibi göründüğünü görebiliriz. Ancak araştırmacılar bir GABA transaminaz (ABAT) döngü enziminin bir kompleks içinde SulcA2 altbirimi ile işlediğini önceden bulmuştu ve ayrıca pürin kurtarmanın son adımlarında da rol alıyor olabilirdi. Bilimciler ayrıca bir mitokondriyal yerelleşme dizilimine sahip bir nükleosid difosfat kinazın (NME4) kompleksin parçası olduğunu düşünüyor. Ama beyinde bu enzimin gerçek düzeyine ilişkin hâlâ bazı soru işaretleri var.
Tam olarak neler olduğuna ilişkin ek bilgiler, bir süre önce keşfedilen yeni bir mekanizma ile elde edildi. Bu mekanizma GABA döngüsü olmadan beyinde GABA üretiyor. Normalde sadece nöronlar glutamattan GABA yapar, çünkü sadece onlarda bunu yapacak GAD enzimi bulunur. Ama mitokondriyal dış zardaki monoamin oksidaz B (MAOB) yoluyla putresini azaltarak glia da GABA üretebilir. Bu özellikle glial Bergmann hücrelerinin bolca bulunduğuu serebellumda yararlıdır. Bergmann gliaları, sekiz gliaya bir Purkinje hücresi oranıyla palisadlar oluşturur ve her bir glia, Purkinje hücresi başına yaklaşık 5000 sinaps koordine eder.
Serebellar ataksiler ve retinal sorunlar, mitokondriyal bozukluklar izgesinde sıkça rastlanan meselelerdir. MAOB X-kromozomu üzerinde kodlandığından, erkekler (sadece annelerinden X kromozomu alırlar) bunu mtDNA'ları (bu da sadece anneden alınır) ile birlikte bir paket hâlinde alırlar. Bunun nedeni hepimizin mitokondrilerimizi sadece annelerimizden almamızdır. Birlikte kalıtılan bu tür bağlantılara bakmak, mitokondriyal hastalıkları deşmede önemli bir araçtır. Bu bilgi, tedavide ne tür ilaçların kullanılabileceğinin anlaşılması açısından da önemlidir.
Örneğin vigabatrin, kullanılan çocukların neredeyse yarısında görme alanı bozukluklarına neden olan kesinlikle korkunç bir ilaçtır. Ne yazık ki, aynı ölçüde korkunç bazı atak nöbetlerine karşı işe yarayan tek ilaç da odur. Yukarıda sözü edilen araştırmacılar, ABAT ile ilgili nükleotit sentezi yollarını göstermek için deneysel olarak vigabatrin kullandı. GABA'ya yapısal olarak çok benzese de, vigabatrin kuvvetli bir ABAT intihar baskılayıcısı olarak rol alır ama GABA almaçlarının hepsine bağlanmaz. GABA düzeyleri, mitokondriyal düzeyler ve mtDNA düzeylerinin tümünün verilen vigabatrin miktarlarına çok duyarlı oldukları kanıtlanmıştır. Vigabatrinin istenmeyen etkileri, önceden var olan mitokondriyal hastalık sahibi bireylere verildiğinde beklenebilir bir şeydir.
Torin-1 adı verilen bir molekülün, vigabatrinin birincil ve ikincil etkilerinin bazılarını en azından kısmen düzeltebildiği de bir süre önce anlaşılmıştır. Mekanizma, GABA'nın mTOR (rapamisinin mekanistik hedefini) etkinleştirme becerisi ile ilgilidir. Böylece mitofaji (kusurlu mitokondrinin saf dışı kalması) ile mitokondrilerin kalabalıklaşmasını veya harcamanın giderilmesini engeller. Bu ayrıca mtDNA'sı hasarlı daha fazla mitokondri kalacağı anlamına gelir. Torin, bir baskılayıcı veya mTor (rapamisine benzer), o halde göz ve beyin gibi aktif dokudaki vigabatrinin negatif etkilerinin bazılarıyla baş etmek için yararlı bir araç olabilir.
Torin çalışmasının yazarları, beynin farklı bölgelerinde, paradoks gibi görünen etkiler gözlemlemiştir. Örneğin, neden gözde, karaciğerde veya parietal kortekste değil de, hipokampüste torin 1 normalize mitokondriyal birikimi olduğunun açıklaması yapılamamıştır. Ayrıca neden hipokampal mitokondrilerin vigabatrin ile arttığı, ama parietal kortekste olmadığı da bilinmemektedir.
Sinir sistemini diğer tüm düşünmeyen organlardan ayıran bir şey -belki de tek belirgin özelliği- onun devasa ve büyük ölçüde kutuplanmış hücreler-arası mitokondri iletimidir. Gerektiğinde bu etkinlik mitokondriler hücreden hücreye iletimini sağlar; çoğunlukla ardından optik sinirde önemli olduğu iyi bilinen mitofaji gelir.
Böylesi hipokampüs ve ilgili kortikal bölgeler arasındaki yerel veya sinir sistemi ile diğer organlar arasındaki daha genel trans-eksüdasyon devreleri, genetik farklılıklarından ötürü spesifik enzimleri olmayan tekil hücrelerde ortaya çıkan metabolik yetersizlikleri doğal biçimde belki de kompanse edebilirdi. GABA döngüsü bunun hoş bir örneğidir.
Mitokondriler, elektronlardan farklı olarak bir-örnek ve kimliği belirsiz varlıklar değildir. Birbirlerinden farklı olarak da olsa ve bazen geri çevrilebilir de olsa yaşlanırlar; hücrelerde ve dokularda buna göre sıralanırlar. Beyindeki gerilim artışları doğrudan metabolik etkinlik sonucudur. Biliyoruz ki bu artışlar mitokondrileri, etkinliklerini ve daha görünür olarak hareketlerini kontrol ediyor. Artık şunu da biliyoruz ki, gerilim artışlarının bu kontrolü elde etme yollarından biri de mitokondrilerdeki nükleotit metabolizmasını manipüle etmek.- MedicalXpress, "GABA, GABA, GABA, what does it actually do in the brain?" https://medicalxpress.com/news/2018-05-gaba-brain.html
- Rían W. Manville et al. Direct neurotransmitter activation of voltage-gated potassium channels, Nature Communications (2018). DOI: 10.1038/s41467-018-04266-w " http://dx.doi.org/10.1038/s41467-018-04266-w
Dilediğiniz miktarda aylık veya tek seferlik bağış yapabilirsiniz.
Destek OlBunlar da İlginizi Çekebilir