Yanlış Katlanmış Proteinlerin Birikmesine Neden Olan Yeni Bir Mekanizma Keşfedildi
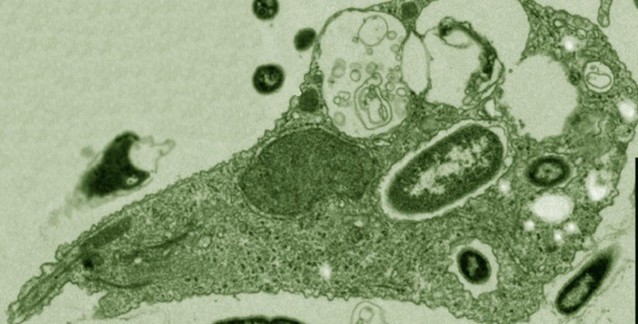
 Dvela-Levitt M, et al. Cell. 2019.
Dvela-Levitt M, et al. Cell. 2019.

Bilimciler, toksik proteinopatiler denilen düzinelerce kalıtımsal hastalığa, hücrelerdeki spesifik yanlış katlanmış proteinlerin birikiminin neden olduğunu uzun süredir biliyordu. Ancak bu birikimden sorumlu olan moleküler mekanizmalar gizemini korumaktaydı. Dolayısıyla tedavi geliştirme çabaları başarıya ulaşamıyordu.
MIT ile Harvard'ın Broad Enstitüsü ve Brigham & Women's Hastanesi araştırmacıları, bu toksik proteinopatilerin bazılarının, daha önce fark edilmeyen tek bir nedenden doğabileceğini keşfetti: Salgı (sekretuvar, İng. secretory) yolağı denilen bir hücresel ulaştırma ağındaki spesifik bir adımdaki sıkışıklık. Söz konusu yolak, proteinleri ya hücre yüzeyine ya da hücrenin protein imha sistemlerinden birine ulaştırıyor.
İlgili makaleyi Cell dergisinde yayımlayan ekip, MUC1 böbrek hastalığı (MKD) adı verilen ender rastlanan bir bozukluğu incelerken bu keşfi yaptı. Araştırmacılar, MUC1 adlı proteinin yanlış katlanmış bir versiyonunun böbrek hücrelerindeki zararlı birikimi nedeniyle hastalığın ortaya çıktığını gösterdi. Dahası, hücrenin yanlış katlanmış proteini kaldırmadaki başarısızlığının, salgı yolağındaki belirli bir moleküler adıma kadar izinin sürülebileceği ve BRD4780 adlı bir bileşiğin trafik sıkışıklığını giderebildiği ortaya kondu. Bileşik, insan böbrek hücreleri ile böbrek organoidlerinde (hasta hücrelerinden alınan hücrelerin mühendisliğinin yapılmasıyla kapta yaşatılan minyatür böbrekler) ve MKD'nin bir hayvan modelinde işe yaradı. BRD4780, şu anda tedavisi olmayan MKD ve başka bazı toksik proteinopatiler için yeni ilaçların geliştirilmesinde bir başlangıç noktası olabilir.
Önceden MCKD (İng. medullary cystic kidney disease) adıyla bilinen MKD, ender rastlanan kalıtımsal bir hastalıktır ve böbrek iflasına yol açar. 2013 yılında, Broad başkanı ve kurucu yöneticisi Eric Lander ile enstitü üyesi Mark Daly liderliğinde bir ekip, MKD'nin genetik kökünü bulmuştu: Fazladan bir harfin mucin-1 genine (MUC1) eklenmesi. Oluşan çerçeve kayması mutasyonu, MUC1-fs denilen tepesi kesik, yanlış katlanmış bir proteinin üretilmesine neden oluyordu. MUC1-fs hastaların böbrek hücrelerinde birikiyordu ve sonunda hücrelerin ölümüne neden olarak, böbrek iflasına yol açıyordu.
MUC1-fs'yi hücrelerden temizlemeye yardım edecek ilaç benzeri bileşikler bulmak için makalenin başyazarı Moran Dvela-Levitt, ekibin kıdemli üyesi Anna Greka ve çalışma arkadaşları, ilaç geliştirme sürecinin farklı evrelerindeki 3700'den fazla bileşiğin bulunduğu Broad İlaç Yeniden Amaçlandırma Merkezi'ne başvurdu. İncelemeler sonucunda, kan basıncı ilacı olarak başarısız olduğu için bir kenara atılan BRD4780 bileşiğinin, normal MUC1'e dokunmadığı fakat MUC1-fs'yi elimine ettiği anlaşıldı. Böylelikle MKD mutasyonu taşıyan böbrek hücrelerinin hayatını kurtarabiliyordu.
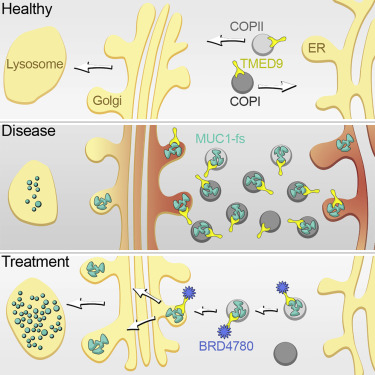
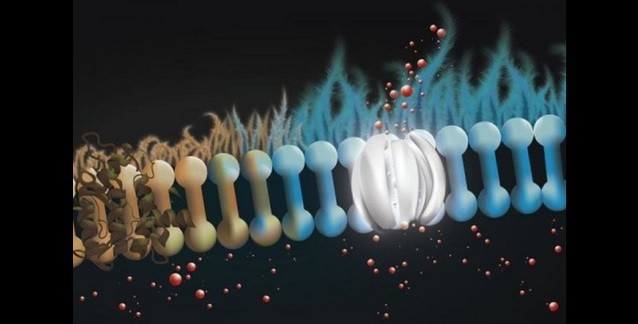
MKD proteinopatisi, yanlış katlanmış MUC1-fs proteinlerinin lizozoma yönlendirilmesiyle geri çevrildi. Yukarıdan aşağıya doğru sağlıklı, hasta ve tedavi süreci durumları görülüyor. Ekip daha yakından baktığında ise BRD4780'in MUC1-fs'ye bağlanmadığını görerek şaşırdı. BRD4780, protein kargosunu salgı yolağı boyunca taşıyan ve bir "kargo almacı" olduğu söylenen TMED9'a tutunuyordu. İnsan böbrek hücrelerinde, bir MKD fare modelinde ve hasta kökenli böbrek organoidlerinde yapılan deneyler, kargo almacının MUC1-fs'yi tuzakladığını gösterdi. Bu, yanlış katlanmış proteinin lizozoma (istenmeyen proteinleri parçalayan bir organel) ulaşmasını önleyerek, böbrek hücrelerinde MUC1-fs'nin tehlikeli düzeylere yükselmesine neden oluyordu.
Bilimciler, BRD4780 TMED9'a bağlandığında, kargo almacının MUC1-fs üzerindeki zaptını bırakarak, hücrenin yanlış katlanmış proteini parçalamasına izin verdiğini fark etti. CRISPR kullanarak TMED9 genini nakavt etmek de (genin işlevini bozmak) aynı etkiyi yapıyordu. "Bu bütünüyle yeni biyoloji," diyor Greka. "TMED9 gibi bir kargo almacının blokaj yapıp, nihayetinde yanlış katlanmış bir proteinin yıkımıyla ilgisinin olabileceğini bilmiyorduk. Soru artık şu: Yanlış katlanmış proteinlerin birikiminin neden olduğu başka durumlarda da aynı biyoloji mi işliyor?"
Toksik proteinopati olarak nitelendirilen 50'den fazla hastalık var. Greka ve çalışma arkadaşları, salgı yolağıyla ilgili benzer sorunların, bu hastalıkların en azından birkaç tanesinden sorumlu olabileceğini düşünüyor. Yapılan in vitro deneylerde araştırmacılar BRD4780'in, RP (retinitis pigmentoza, tavuk karası veya ağkatman körlüğü adlarıyla bilinen kalıtımsal retina dejenerasyonu) ve UKD (UMOD ile ilişkili böbrek hastalığı denilen genetik bir böbrek bozukluğu) hücrelerinin sağkalımını artırdığını, yanlış katlanmış protein düzeylerini düşürebildiğini gördü.
Ekip, BRD4780'e benzeyen ilaçların, yanlış katlanmış proteinlerin salgı yolağının başlarında tuzaklanmış duruma geldiği 20 civarında hastalığı geriye çevirebileceğini tahmin ediyor. "Bu bozuklukların çoğu aynı mekanizmaya dayanıyor olabilir," diyen Greka, atacakları bir sonraki adımın kargo almaçlarına, neden yanlış katlanmış proteinlerin elimine edilmesini durdurduklarına ve onlara karşı tam olarak nasıl ilaç geliştirilebileceğine ilişkin daha derin bir kavrayış geliştirmek olduğunu belirtiyor.- A molecular traffic jam may underlie a rare kidney disease and several other protein misfolding disorders https://www.broadinstitute.org/news/molecular-traffic-jam-may-underlie-rare-kidney-disease-and-several-other-protein-misfolding
- Proteinopathy Cleared Up after Cargo Receptor Made to Give Up Misfolded Protein https://www.genengnews.com/news/proteinopathy-cleared-up-after-cargo-receptor-made-to-give-up-misfolded-protein/
- Molecular traffic jam may underlie rare kidney disease, other protein misfolding disorders https://medicalxpress.com/news/2019-07-molecular-traffic-underlie-rare-kidney.html
- Dvela-Levitt M, et al. Small molecule targets TMED9 and promotes lysosomal degradation to reverse proteinopathy. Cell. Online July 25, 2019. DOI: 10.1016/j.cell.2019.07.002 http://dx.doi.org/10.1016/j.cell.2019.07.002
Dilediğiniz miktarda aylık veya tek seferlik bağış yapabilirsiniz.
Destek OlBunlar da İlginizi Çekebilir